
| A、金刚石>晶体硅>二氧化硅 |
| B、HI>HBr>HCl>HF |
| C、NaF>NaCl>NaBr |
| D、NaCl>Hg>S |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
n- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原饱和溶液中减少的Na2SO4的质量 |
| B、原饱和溶液中失去的水的质量 |
| C、原饱和溶液中失去的水和NaSO4的质量总和 |
| D、析出晶体中含有的Na2SO4的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a-4 | B、a+1 |
| C、a+3 | D、a+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、医学上用于消毒的酒精是75%酒精溶液 |
| B、单质硅是将太阳能转化为电能的常用材料 |
| C、食醋是含3%~5%乙酸的溶液 |
| D、乙醇可做为提取碘水中碘的萃取剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
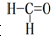 )、苯、二氧化碳及水说法不正确的是( )
)、苯、二氧化碳及水说法不正确的是( )| A、苯与B3N3H6互为等电子体,且分子中原子共平面 |
| B、甲醛、苯和二氧化碳中碳原子均采用sp2杂化 |
| C、苯、二氧化碳是非极性分子,水和甲醛是极性分子 |
| D、水的沸点比甲醛高得多,是因为水分子间能形成氢键,而甲醛分子间不能形成氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na、Mg、Al还原性依次增强 |
| B、HCl、PH3、H2S稳定性依次减弱 |
| C、LiOH、NaOH、KOH碱性依次减弱 |
| D、O2-、F-、Na+、Mg2+的离子半径依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A、该反应的化学方程式为3B+4D?6A+2C |
| B、反应进行到1s时,v(A)=v(D) |
| C、反应进行到6s时,各物质的百分含量不变 |
| D、反应进行到6s时,B的平均反应速率为0.05mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2和CO2都属于原子晶体 |
| B、SiO2和CO2都是分子晶体 |
| C、前者是原子晶体,后者是分子晶体 |
| D、前者是分子晶体,后者是原子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com