
分析 依据n=$\frac{V}{Vm}$计算氯化氢的物质的量,然后再依据c=$\frac{n}{V}$计算盐酸的物质的量浓度;
HCl是强电解质,完全电离,每摩尔HCl可电离出1molCl-.
解答 解:(1)标准状况下的2.24 L HCl气体,物质的量n=$\frac{2.24L}{22.4L/mol}$=0.1mol,溶于水配成200 mL溶液,则盐酸溶液的物质的量浓度C=$\frac{n}{V}$=$\frac{0.1mol}{0.2L}$=0.5mol/L;
答:所得盐酸溶液的物质的量浓度是0.5 mol/L;
(2)溶液具有均一性,50ml盐酸溶液,C(HCl)=0.5mol/L,则C(Cl-)=0.5mol/L,n(Cl-)=0.5mol/L×0.05L=0.025mol;
答:所得盐酸溶液中Cl-的物质的量为0.025mol.
点评 本题考查物质的量浓度有关计算,明确以物质的量为核心的相关公式是解题关键,注意溶液中溶质分子与离子的浓度大小关系,题目难度不大.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:解答题
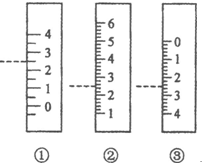 以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:
以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaHCO3、Na2SO3、FeCl3溶液蒸干灼烧均得不到原溶质 | |
| B. | 保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解 | |
| C. | 室温下,向0.1mol/L的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大 | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
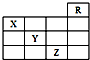
| A. | Z的原子序数比Y大19 | |
| B. | Z的单质常温下是深棕色液体,具有氧化性 | |
| C. | 同浓度的Y、Z的气态氢化物的水溶液的酸性Y>Z | |
| D. | X的气态氢化物与Y最高价氧化物对应的水化物的溶液能发生反应生成盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示装置中,M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )
如图所示装置中,M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )| M | N | R | |
| A | 锌 | 铜 | 稀硫酸 |
| B | 铜 | 铁 | 硫酸铜 |
| C | 铁 | 铜 | 硝酸银 |
| D | 铜 | 铁 | 氯化铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L气体氘气(D2)中含有0.5NA个中子 | |
| B. | 1 L 0.1 mol•L-1醋酸溶液中含有0.1NA个氢离子 | |
| C. | 电解精炼铜时,若电路中转移0.2NA个电子,则阳极质量一定减少6.4 g | |
| D. | NO2和H2O反应每生成2 mol HNO3时被还原的NO2分子数为NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com