
W、X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性
请回答下列问题:
(1)Y在元素周期表中的位置为_________,上述元素的最高价氧化物对应的水化物酸性最强的是_____(写化学式),W、Y、Z、M形成的简单离子的半径大小顺序是___________________(用化学符号表示)。
(2) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有_______(写单质的化学式)、_________(写出化合物的化学式)。
(3) Y与M的氢化物中,热稳定性更好的是____________(填化学式),原因是_____________________
(4) ZW的电子式为__________,ZW与水反应放出气体的化学方程式为__________________________。
(5)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的X4分子。X4分子结构如下图所示,已知断裂lmolX-X吸收167kJ热量,生成1mo1X2放出942kJ热量。根据以上信息和数据,下列说法正确的是____________。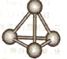
A.X4沸点比P4(白磷)低,属于原子晶体
B.lmol X4气体转变为X2吸收882kJ热量
C.X4与X2互为同素异形体
(6)发射“神六”时用X2W4作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知声称1mol水蒸气时放热283.9KJ,写出X2W4 (g)和NO2(g)反应的热化学方程式______________________________________
同时,X2W4可作为新型燃料电池的燃料,在氧气中燃烧生成氮气和水,请利用X2W4、氧气与KOH溶液组成碱性燃料电池,写出该电池负极的电极反应式________________________,指出电解质溶液中OH-离子向________极移动。
(19分)第二周期ⅥA族(1分),HClO4(1分),S2-> O2->Na+>H+(2分)
(2) O3或Cl2(1分)、ClO2(1分)
(3) H2O (1分),O的非金属性大于S (2分)
(4)  (2分);NaH+H2O==NaOH+H2↑(2分)
(2分);NaH+H2O==NaOH+H2↑(2分)
(5) C(1分)
(6) 2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g) △H = -1135.6KJ/mol(2分,未写状态扣1分,△H未写或计算错误或单位未写扣1分) N2H4 -4e-+4OH-==N2+4H2O (2分),负(1分)
解析试题分析:X的气态氢化物水溶液呈碱性,则X一定是氮元素。Y、M同主族,可形成MY2、MY3两种分子,属于M是S元素,Y是氧元素。W、Z同主族,可形成离子化合物ZW,则Z是Na,W是H元素。
(1)Y在元素周期表中的位置为第二周期ⅥA族,非金属性越强,最高价氧化物的水化物的酸性越强,则上述元素的最高价氧化物对应的水化物酸性最强的是HClO4。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,则W、Y、Z、M形成的简单离子的半径大小顺序是S2-> O2->Na+>H+。
(2) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有O3或Cl2或ClO2。
(3)非金属性越强,氢化物的稳定性越强。O的非金属性大于S,所以水的沸点高于H2S的。
(4)NaH是离子化合物,其电子式为 ,与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑。
,与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑。
(5)X4沸点比P4(白磷)低,属于分子晶体,A不正确;lmol X4气体转变为X2应该是放出167kJ×6-942kJ ×2=882kJ热量,B不正确。由同一种元素形成的不同单质互为同素异形体,C正确,答案选C。
(6)1mol水蒸气时放热283.9KJ,则该反应的热化学方程式是2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g) △H = -1135.6KJ/mol。原电池中负极失去电子,则该电池负极的电极反应式是N2H4 -4e-+4OH-==N2+4H2O。原电池中阴离子向负极移动。
考点:考查元素周期表的结构、元素周期律的应用、电子式以及方程式的书写、反应热的计算
点评:该题是高考中的常见题型,所以中等难度的试题。试题综合性强,侧重对学生能力的培养和基础性知识的巩固与训练,有助于培养学生的逻辑推理能力和发散思维能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省八市高三三月联考理综化学试卷(解析版) 题型:选择题
原子序数依次增大的短周期主族元素W、X、Y、Z和M中,W的最外层电子数为其周期数的二倍;X和Z的A2B型氢化物均为V形分子,Y的+1价离子比M的-1价离子少8个电子。根据以上叙述,下列说法中正确的是
A.上述四种元素的原子半径大小为W<X<Y<Z<M
B.由这些元素形成的三原子分子中,空间结构为直线形的有WX2,WZ2,ZX2
C.元素W与氢形成的原子个数比为1﹕1的化合物有很多种
D.X与Y可形成含有非极性共价键的共价化合物
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高一下学期期中考试化学理科试卷(解析版) 题型:填空题
W、X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性
请回答下列问题:
(1)Y在元素周期表中的位置为_________,上述元素的最高价氧化物对应的水化物酸性最强的是_____(写化学式),W、Y、Z、M形成的简单离子的半径大小顺序是___________________(用化学符号表示)。
(2) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有_______(写单质的化学式)、_________(写出化合物的化学式)。
(3) Y与M的氢化物中,热稳定性更好的是____________(填化学式),原因是_____________________
(4) ZW的电子式为__________,ZW与水反应放出气体的化学方程式为__________________________。
(5)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的X4分子。X4分子结构如下图所示,已知断裂lmolX-X吸收167kJ热量,生成1mo1X2放出942kJ热量。根据以上信息和数据,下列说法正确的是____________。
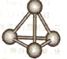
A.X4沸点比P4(白磷)低,属于原子晶体
B.lmol X4气体转变为X2吸收882kJ热量
C.X4与X2互为同素异形体
(6)发射“神六”时用X2W4作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知声称1mol水蒸气时放热283.9KJ,写出X2W4 (g)和NO2(g)反应的热化学方程式______________________________________
同时,X2W4可作为新型燃料电池的燃料,在氧气中燃烧生成氮气和水,请利用X2W4、氧气与KOH溶液组成碱性燃料电池,写出该电池负极的电极反应式________________________,指出电解质溶液中OH-离子向________极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
W、X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性
请回答下列问题:
(1)Y在元素周期表中的位置为_________,上述元素的最高价氧化物对应的水化物酸性最强的是_____(写化学式),W、Y、Z、M形成的简单离子的半径大小顺序是___________________(用化学符号表示)。
(2) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有_______(写单质的化学式)、_________(写出化合物的化学式)。
(3) Y与M的氢化物中,热稳定性更好的是____________(填化学式),原因是_____________________
(4) ZW的电子式为__________,ZW与水反应放出气体的化学方程式为__________________________。
 (5)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的X4分子。X4分子结构如下图所示,已知断裂lmolX-X吸收167kJ热量,生成1mo1X2放出942kJ热量。根据以上信息和数据,下列说法正确的是____________。
(5)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的X4分子。X4分子结构如下图所示,已知断裂lmolX-X吸收167kJ热量,生成1mo1X2放出942kJ热量。根据以上信息和数据,下列说法正确的是____________。
A.X4沸点比P4(白磷)低,属于原子晶体
B.lmol X4气体转变为X2吸收882kJ热量
C.X4与X2互为同素异形体
(6)发射“神六”时用X2W4作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知声称1mol水蒸气时放热283.9KJ,写出X2W4 (g)和NO2(g)反应的热化学方程式______________________________________
同时,X2W4可作为新型燃料电池的燃料,在氧气中燃烧生成氮气和水,请利用X2W4、氧气与KOH溶液组成碱性燃料电池,写出该电池负极的电极反应式________________________,指出电解质溶液中OH-离子向________极移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com