
减小 NaOH与空气中CO2反应 V(A)=V(B) V(A)<V(B)
解析:NaOH溶液放置于空气中,因NaOH与空气中CO2反应,使NaOH减小,故溶液的pH减小。
用H2SO4滴定Na2CO3溶液,反应分两个阶段进行:
a.H++![]() ====
====![]() (此时溶液呈弱碱性);
(此时溶液呈弱碱性);
b.H++![]() ====CO2↑+H2O(溶液呈弱酸性)。
====CO2↑+H2O(溶液呈弱酸性)。
滴定过程按哪种反应进行,取决于选择的指示剂。①若选用甲基橙作指示剂,因其变色范围在pH=3.1—4.4,滴定反应按b进行,由关系式2NaOH![]() Na2CO3
Na2CO3![]() CO2↑知,消耗的H2SO4的量不变,故答案为V(A)=V(B)。②若选用酚酞作指示剂,酚酞的变色范围为pH=8—10,滴定反应按a进行,消耗H2SO4的量减小,故答案为V(A)<V(B)。
CO2↑知,消耗的H2SO4的量不变,故答案为V(A)=V(B)。②若选用酚酞作指示剂,酚酞的变色范围为pH=8—10,滴定反应按a进行,消耗H2SO4的量减小,故答案为V(A)<V(B)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
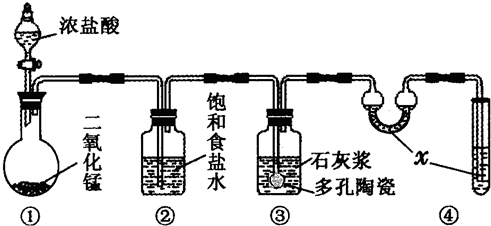
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源:宁夏银川一中2011-2012学年高二下学期期中考试化学试题 题型:013
|
室温时取浓度相同的NaOH和HCl溶液,以2∶1体积比相混合,所得溶液的pH等于12,则原溶液的浓度为 | |
| [ ] | |
A. |
0.05 mol/L |
B. |
0.03 mol/L |
C. |
0.02 mol/L |
D. |
0.50 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
,易溶于水。为了研究乳酸的分子组成和结构,进行下述实验:
(1)称取乳酸0.90 g,在某种状况下使其完全汽化,已知相同状况下同体积氢气为0.02 g,则乳酸的相对分子质量为_________________。
(2)若将上述乳酸蒸气在O2中燃烧只生成CO2和H2O(g),当全部被碱石灰吸收时,碱石灰增重1.86 g。若将此气体通过足量石灰水后,则石灰水会产生3.00 g 白色沉淀,则乳酸的分子式为_________________。
(3)乳酸分子能发生自身酯化反应,其催化氧化物不能发生银镜反应,葡萄糖发酵只生成乳酸,试写出葡萄糖生成乳酸的化学方程式:________________________________________。
(4)写出乳酸在催化剂作用下发生反应,生成分子式为C6H8O4的环状酯的结构简式:
__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由葡萄糖发酵可得乳酸,酸牛奶中也能提取乳酸,纯净乳酸为无色黏稠液体,易溶于水。为了研究乳酸的分子组成和结构,进行下述实验:
(1)称取乳酸0.90 g,在某种状况下使其完全汽化,已知相同状况下同体积氢气为0.02 g,则乳酸的相对分子质量为_________________。
(2)若将上述乳酸蒸气在O2中燃烧只生成CO2和H2O(g),当全部被碱石灰吸收时,碱石灰增重1.86 g。若将此气体通过足量石灰水后,则石灰水会产生3.00 g 白色沉淀,则乳酸的分子式为_________________。
(3)乳酸分子能发生自身酯化反应,其催化氧化物不能发生银镜反应,葡萄糖发酵只生成乳酸,试写出葡萄糖生成乳酸的化学方程式:________________________________________。
(4)写出乳酸在催化剂作用下发生反应,生成分子式为C6H8O4的环状酯的结构简式:
__________________________________。
查看答案和解析>>
科目:高中化学 来源:2011届浙江省杭州二中高三5月模拟(理综)化学部分 题型:实验题
(16分)(Ⅰ)本世纪是生命科学研究的昌盛时期, 科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol?L-1。
科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol?L-1。
⑴ 请根据测定原理写出有关反应的离子方程式 ▲ ;
⑵ 计算该样品此时c(O2-) = ▲ ;
⑶ 如用羟胺氧化法测定O2-时,将其生成的过氧化物作为检测物,若选用氧化还原法进行定量分析(用KMnO4标准溶液进行滴定)
① 请写出其测定原理的反应方程式 ▲ ;
② 测定所用的主要玻璃仪器为 ▲ ,通过观察 ▲ 的现象可确定测定反应是否进行完全。
(Ⅱ)水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一。检测水中的NO2-可用比色法,其步骤是:
a. 配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
b. 配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平
底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对苯磺酸粉末,实验结果如下表所示:
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com