
| A. | 溶质为NaHCO3 | |
| B. | 溶质为Na2CO3 | |
| C. | 增重的4.4g为参加反应的CO2的质量 | |
| D. | 低温蒸干溶液,所得固体的质量为:(原溶液中NaOH的质量+4.4g) |
分析 向0.50L 0.3 mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重4.4g,增重4.4g是二氧化碳,物质的量为0.1mol,溶液中含有氢氧化钠为0.15mol,n(CO2):n(NaOH)=1:1.5.二氧化碳与氢氧化钠可能发生反应①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H2O,由于n(CO2):n(NaOH)=1:1.5,介于1:1与1:2之间,两个反应都发生.令生成的碳酸氢钠为xmol,生成的碳酸钠为ymol,根据钠元素守恒有x+2y=0.15,根据碳元素守恒有x+y=0.1,联立方程计算x、y的值,以此计算解答.
解答 解:向0.50L 0.3 mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重4.4g,增重4.4g是二氧化碳,物质的量为$\frac{4.4g}{44g/mol}$=0.1mol,溶液中含有氢氧化钠为0.5L×0.3mol/L=0.15mol,n(CO2):n(NaOH)=1:1.5.
二氧化碳与氢氧化钠可能发生反应①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H2O.由于n(CO2):n(NaOH)=1:1.5,介于1:1与1:2之间,两个反应都发生,溶液为碳酸钠与碳酸氢钠的混合溶液.
令生成的碳酸氢钠为xmol,生成的碳酸钠为ymol,生成的碳酸钠为ymol,
根据钠元素守恒有x+2y=0.15,根据碳元素守恒有x+y=0.1,联立方程解得x=0.05、y=0.05.
A.由分析可知,溶液为碳酸钠与碳酸氢钠的混合溶液,故A错误;
B.由分析可知,溶液为碳酸钠与碳酸氢钠的混合溶液,故B错误;
C.由分析可知,增重的4.4g为参加反应的CO2的质量,故C正确;
D.低温蒸干溶液,所得固体的质量为碳酸钠与碳酸氢钠,二氧化碳与氢氧化钠反应生成碳酸钠与水,所以固体等于原溶液中NaOH的质量+4.4g-二氧化碳与氢氧化钠反应生成的水的质量,故D错误.
故选C.
点评 本题考查化学反应的有关计算,把握二氧化碳与氢氧化钠的物质的量判断发生的反应是关键,侧重分析与计算能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
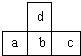 如图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法不正确的是( )
如图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法不正确的是( )| A. | a、b、c的最高价氧化物对应水化物的酸性强弱的关系是c>b>a | |
| B. | d的氢化物比b的氢化物稳定 | |
| C. | d与c不能形成化合物 | |
| D. | 原子半径的大小顺序是a>b>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的任何物质,其物质的量一定相等 | |
| B. | 等质量的SO2和SO3中所含硫原子数相等 | |
| C. | 1L氮气一定比1L氧气的质量小 | |
| D. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
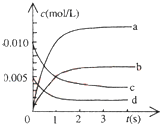 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由2Cu+O2 $\frac{\underline{\;△\;}}{\;}$2CuO可推出Cu+S$\frac{\underline{\;△\;}}{\;}$CuS | |
| B. | SO2是酸性氧化物,则SO3也是酸性氧化物 | |
| C. | 相同质量的N4和N2所含原子个数比为1:1 | |
| D. | 石墨、金刚石、C60为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2与盐酸 Cu(OH)2与醋酸 | |
| B. | BaCl2溶液与Na2SO4溶液 Ba(OH)2溶液与Na2SO4溶液 | |
| C. | NaHCO3溶液与NaHSO4溶液 Na2CO3溶液与NaHSO4溶液 | |
| D. | 石灰石与硝酸 生石灰与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同



| A. | (1)(2)(4)(6) | B. | (2)(3)(5) | C. | (1)(4)(5)(8) | D. | (1)(2)(5)(8) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com