
| A. | NaHCO3溶液中含有少量Na2CO3,可以用澄清石灰水除去 | |
| B. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 | |
| C. | 加水稀释CH3COONa溶液,溶液中的所有离子浓度都减小 | |
| D. | 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解 |
分析 A.加入澄清石灰水,碳酸氢钠和碳酸钠都会反应生成碳酸钙沉淀;
B.新制氯水中氯气和水反应生成盐酸具有酸性,生成次氯酸具有漂白性、强氧化性;
C.温度不变,水的离子积常数不变,氢离子浓度减小,氢氧根离子浓度增大;
D.工业上用电解熔融氧化铝的方法制取氧气,氧化铝在通电条件下生成铝和氧气.
解答 解:A.NaHCO3溶液中含有少量Na2CO3,发生反应2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-,Ca2++CO32-=CaCO3↓,都会生成沉淀,不能用澄清石灰水除去,故A错误;
B.新制氯水中氯气和水反应生成盐酸具有酸性,生成次氯酸具有漂白性、强氧化性,向其中滴加少量紫色石蕊试液,充分振荡后溶液先变红色后褪色,故B错误;
C.加水稀释时促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)减小,温度不变,水的离子积常数不变,则溶液中c(OH-)增大,故C错误;
D.工业上用电解熔融氧化铝的方法制取氧气,氧化铝在通电条件下生成铝和氧气,化学方程式:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2,故D正确;
故选D.
点评 本题考查了离子反应,氯水性质,弱电解质溶液稀释,注意次氯酸的漂白性和水溶液中存在离子积常数的理解应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 组 别 | 被选出的物质 | 挑选依据 |
| 第(1)组 | ||
| 第(2)组 | ||
| 第(3)组 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
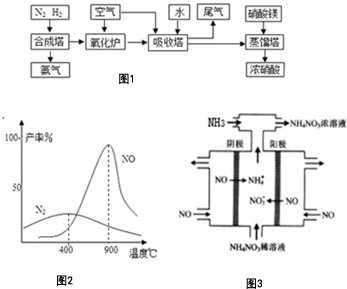 氨、硝酸、硝酸铵、硝酸铜是重要的化工产品.工业合成氨与制备硝酸一般可连续生产,流程如图1:请回答下列问题
氨、硝酸、硝酸铵、硝酸铜是重要的化工产品.工业合成氨与制备硝酸一般可连续生产,流程如图1:请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 联合制碱法中循环使用CO2和NH3,以提高原料利用率 | |
| B. | 硫酸工业中,SO2氧化为SO3时采用常压,因为高压会降低SO2转化率 | |
| C. | 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 | |
| D. | 炼钢是在高温下利用氧化剂把生铁中过多的碳和其他杂质氧化成气体或炉渣除去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com