
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-,横坐标表示加入NaOH的体积)。根据图示判断,下列说法正确的是
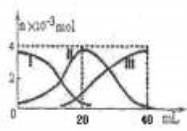
A.当V(NaOH)=40mL时,c (Na+)+ c(H+)=2 c(A2-)+c(OH-)
B.当V(NaOH)=20mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.滴加过程中当溶液呈中性时,V(NaOH)<20mL
D.HA-的电离程度小于水解程度
B
【解析】
试题分析:A.根据电荷守恒可得,c (Na+)+ c(H+)=2 c(A2-)+c(OH-)+c(HA-)。错误。B.当V(NaOH)=20mL时,二者恰好发生反应:H2A+NaOH=NaHA+H2O,由于HA-会发生电离作用,c(Na+)>c(HA-),在溶液中除了HA-电离会产生H+外,水也会电离产生H+,所以c(H+)>c(A2-);但是弱电解质的电离远远小于盐的电离,所以c(HA-)>c(H+)。因此在溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。正确。C.由于当二者按照1:1混合时得到的溶液为NaHA,溶液显酸性,所以滴加过程中当溶液呈中性时,NaOH溶液的体积要大于20ml。即V(NaOH)>20mL。错误。D.根据图像可知在NaHA的溶液显酸性,说明HA-电离程度大于水解程度。错误。
考点:考查弱酸的酸式盐与碱反应时离子浓度的大小比较及溶液的酸碱性的知识。


科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:填空题
(3分)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的是
(填序号),写出反应⑥的化学方程式__ __ __。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省5月月考高二化学试卷(解析版) 题型:选择题
下列物质的类别与所含官能团都正确的是
A.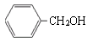 酚类 –OH B.
酚类 –OH B.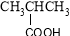 羧酸 –CHO
羧酸 –CHO
C.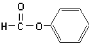 醛类 –CHO D.CH3-O-CH3 醚类
醛类 –CHO D.CH3-O-CH3 醚类 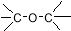
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省6月高二化学期末测试卷(解析版) 题型:选择题
有机物 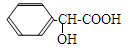 有多种同分异构体,其中能够发生水解反应且能与氯化铁溶液发
有多种同分异构体,其中能够发生水解反应且能与氯化铁溶液发
生显色反应的同分异构体有(不考虑立体异构)
A.6种 B.9种 C.15种 D.19种
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:填空题
(15分)
已知:(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:

4FeCl3+2NH2OH·HCl 4FeCl2+N2O↑+6HCl+H2O
4FeCl2+N2O↑+6HCl+H2O
①Fe2+在基态时,价层电子排布式 。 ②羟胺(NH2OH)中N原子的杂化方式 。
③Fe2+与邻啡罗啉形成的配合物中,配位数为 。
(2)硫酸铜晶体的化学式也可以表达为Cu(H2O)4SO4·H2O晶体,该晶体中含有的化学键类型是
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、磷化镓及铜锢硒薄膜电池等。 其中元素P、As、Se第一电离能由小到大的顺序为: 。
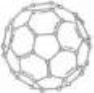

图1 图2
(4)① 有机太阳能固体电池材料含有高纯度C60,其结构如图1,则1 mol C60分子中π键的数目为 ,C60的晶胞结构如图2,则其配位数为_______若此晶胞的密度为ρg/cm3则两个最近C60间的距离为________cm(列式表达,已知阿伏伽德罗常数为NA)
② 如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。若每个四面体空隙填入一个原子,则全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列说法正确的是
A.60克SiO2含有2NA个Si-O共价键
B.1.0 L 1.0 mo1/L的NaAlO2水溶液中含有的氧原子数为2NA
C.8.2 g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA
D.NA个Fe(OH)3胶体粒子的质量为107g
查看答案和解析>>
科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:填空题
(15分)在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
⑴液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式 。
⑵实验室用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是 (填序号字母)。
A.酒精灯 B.长直玻璃导管C.锥形瓶 D.直型冷凝管
E.尾接管(接液管)F.蒸馏烧瓶 G.滴定管
②除上述必需的仪器外,还缺少的主要玻璃仪器是 。
⑶肼能使锅炉内壁的铁锈变成较为致密的磁性氧化铁(Fe3O4)层,以减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe3O4,需要消耗肼的质量为 g。
⑷磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4;
假设3. 。
探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是 。
②若所得溶液显血红色,则假设 成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生 现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若产生 现象,则假设3成立。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省青岛市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列关于有机物的叙述正确的是
A.甲苯分子中所有原子均在同一个平面上
B.乙烯使KMnO4溶液褪色,是因为两者发生了加成反应
C.分子式为C4H9Br的同分异构体共有4种(不考虑立体异构)
D.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:选择题
据最近的美国《农业研究》杂志报道,美国的科学家发现半胱氨酸能增强艾滋病毒感染者的免疫力,对控制艾滋病毒的蔓延有奇效。已知半胱氨酸的结构简式为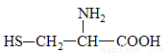 ,则下列说法错误的是
,则下列说法错误的是
A.两分子半胱氨酸脱水形成的二肽结构简式为:
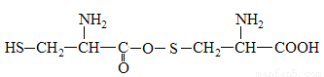
B.半胱氨酸是一种两性物质
C.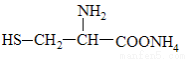 可与过量NaOH溶液反应放出氨气
可与过量NaOH溶液反应放出氨气
D.天然蛋白质水解产物均为α-氨基酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com