
| A. | 元素A所形成的氢化物常温下一定为气态 | |
| B. | 非金属性:A<E | |
| C. | 元素C、D、E在自然界中均不能以游离态存在 | |
| D. | 元素B的氧化物对应的水化物一定为强酸 |
分析 E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,说明E元素最外层电子数为6,则C最外层电子数为2,B、C、E原子的最外层电子数之和为13,说明B元素最外层电子数为13-6-2=5,则B元素的核外电子数为2+5=7,为N元素,E的原子序数最大,应为S元素,则C应为Mg元素,B、D原子最外层电子数之和等于C、E原子最外层电子数之和,即2+6=8,则D的最外层电子数为8-5=3,应为Al元素,A、B两元素相邻,则A应为C元素,结合元素对应单质化合物的性质以及元素周期律解答该题.
解答 解:E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,说明E元素最外层电子数为6,则C最外层电子数为2,B、C、E原子的最外层电子数之和为13,说明B元素最外层电子数为13-6-2=5,则B元素的核外电子数为2+5=7,为N元素,E的原子序数最大,应为S元素,则C应为Mg元素,B、D原子最外层电子数之和等于C、E原子最外层电子数之和,即2+6=8,则D的最外层电子数为8-5=3,应为Al元素,A、B两元素相邻,则A应为C元素,则A为C元素,B为N元素,C为Mg元素,D为Al元素,E为S元素,
A.元素C所形成的氢化物中,如C原子数大于4个,则为液态或固态,故A错误;
B.非金属性C<S,如硫酸的酸性大于碳酸,可证明,故B正确;
C.S可存在于火山喷口附近,故C错误;
D.如为HNO2,则为弱酸,故D错误.
故选B.
点评 本题考查原子的结构与元素的性质,为高考常见题型,题目难度中等,解答本题时,正确推断元素的种类为解答该题的关键,注意元素周期律的把握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
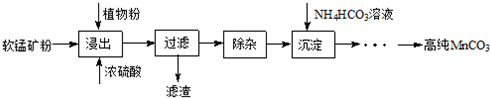
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
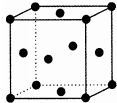 X、Y、Z、R、T为前四周期元素,且原子序数依次增大,Y与R同族,Y的氢化物常温下为无色无味的液体,X与Y可形成直线形分子XY2,Z的基态原子p轨道上电子总数为7,T2+离子的3d轨道上有3个电子.
X、Y、Z、R、T为前四周期元素,且原子序数依次增大,Y与R同族,Y的氢化物常温下为无色无味的液体,X与Y可形成直线形分子XY2,Z的基态原子p轨道上电子总数为7,T2+离子的3d轨道上有3个电子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
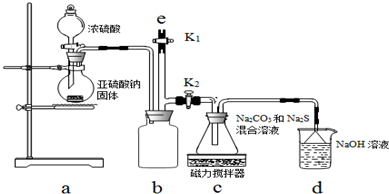
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计 | 观察或记录 | 结论或解释 |
| A | 将浓硝酸分多次加入Cu和稀硫酸的混合液中 | 产生红棕色气体 | 浓硝酸的还原产物是NO2 |
| B | 测某铵盐溶液的pH | pH>7 | NH4+水解生成NH3•H2O,使溶液显碱性 |
| C | 用湿润的淀粉碘化钾试纸检验某气体 | 试纸变蓝 | 该气体一定是Cl2 |
| D | 将盛少量水的分液漏斗静置、倒置、将塞子旋转1800后再次倒置 | 漏斗口和活塞不漏水 | 分液漏斗不漏液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
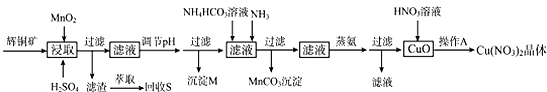
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 乙醇反应时断键部位 | B | 基团的相互影响 |
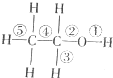 (1)和浓硫酸共热到170℃时②⑤断键 (2)和浓硫酸共热到140℃时只断键② | (1)与钠反应时乙醇比水慢,说明受乙基影响,醇羟基中H原子活泼性减弱 (2)苯酚浊液中加Na0H溶液变澄清,说明受苯环影响,酚羟基中H原子活泼性增强 | ||
| C | 分离提纯 | D | 醇、酚用途 |
| (1)工业乙醇通过蒸馏得无水乙醇 (2)苯中混有苯酚,加溴水沉淀后过滤,除去三溴苯酚沉淀 | (1)甘油加水作护肤剂 (2)酚类化合物有毒,不能用于杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
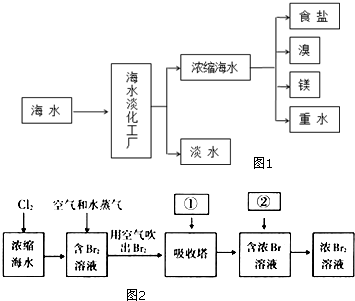 浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,如图1是海水加工的示意图,根据如图回答问题.
浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,如图1是海水加工的示意图,根据如图回答问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com