已知A、B、C、D、E、F、G为七种短周期的主族元素,原子序数依次增大.已知:A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体.C与B、G在元素周期表中处于相邻位置,这三种元素最外层电子数之和为17,质子数之和为31.D与F同周期,且在该周期中D元素的原子半径最大.根据以上信息回答下列问题:
(1)B、C、G的氢化物中稳定性最强的是
(填化学式),G的某种氧化物能使溴水褪色,写出该反应的化学方程式
.
(2)B、C、D、E、F形成的简单离子半径由大到小的顺序为
(用离子符号表示).
(3)A与B能形成离子化合物A
5B,A
5B中既含离子键又含共价键,其电子式为
,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是
.
(4)碳酸盐DACO
3溶液与稀硫酸混合,当生成11.2L(标准状况)气体(不考虑气体溶解)时放热6.32kJ,写出该反应的热化学离子方程式
.
(5)美国国家科学院(National Academy of Sciences)正式发表了题为《行星系统中有机生命的限制》的研究报告.报告称,在温度、压力、物质基础以及能源供给方式都与地球迥异的地外行星上,如果存在生命,它们完全没有必要以地球生命的形式存在. 有学者提出,在大气中充满B元素单质并含有丰富的A的化合物的星球上可能存在“B基生命”而不是“碳基生命”.科学家猜想这样的星球上可能会存在着一种组成结构与BA
3、B
2A
4类似的系列化合物如B
3A
5、B
4A
6等.该系列化合物的通式为
(用元素符号表示).有B
2A
4与另外两种等物质的量的该系列中的化合物组成的混合蒸气,在足量氧气中充分燃烧,只生成B元素的单质和水,且B元素的单质和水的物质的量之比为1:2,则另外两种化合物是
(写化学式).

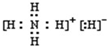 ,该物质能与水剧烈反应生成两种气体,应生成H2、NH3,
,该物质能与水剧烈反应生成两种气体,应生成H2、NH3,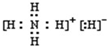 ;H2、NH3;
;H2、NH3;



 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: