


科目:高中化学 来源: 题型:
A、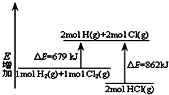 表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183 kJ?mol-1 | B、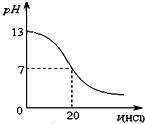 表示室温时用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1NaOH溶液,溶液pH随加入酸体积变化 | C、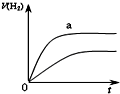 表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | D、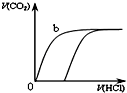 表示10 mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1mol/L HCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江嵊泗中学高二下学期第二次月考化学试卷(平行班)(带解析) 题型:填空题
(10分)已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液的pH=________;
(2)HA的电离平衡常数K=________;
(3)升高温度时,K将______(填“增大”、“减小”或“不变”),pH将______(填“增大”、“减小”或“不变”);
(4)由HA电离出的c(H+)约为水电离出的c(H+)的________倍。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三回头考试化学试卷(解析版) 题型:选择题
现有甲、乙、丙、丁、戊五种离子化合物形成的溶液,分别由K+、NH4+、Ag+、Ba2+、Fe3+、Cl-、OH-、CO32-、SO42-、NO3-中的阳离子和阴离子各一种组成(五种离子化合物所含阴、阳离子各不相同)。已知:①室温时,0.1 mol·L-1乙溶液的pH=10,②丙、丁、戊三种溶液的pH均小于7,③丙溶液分别与其他四种溶液反应均生成沉淀,④甲溶液与丁溶液在加热条件下反应既产生白色沉淀又产生刺激性气味的气体,生成的白色沉淀不溶于稀硝酸。根据以上实验事实可以推断( )
A.甲为K2SO4溶液 B.乙为K 2CO3溶液 C.戊为Fe(NO3)3溶液 D.丁为NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三上学期期中考试化学试卷 题型:选择题
现有甲、乙、丙、丁、戊五种离子化合物形成的溶液,分别由K+、NH4+、Ag+、Ba2+、Fe3+、Cl-、OH-、CO32-、SO42-、NO3-中的阳离子和阴离子各一种组成(五种离子化合物所含阴、阳离子各不相同)。已知:①室温时,0.1 mol·L-1乙溶液的pH=10,②丙、丁、戊三种溶液的pH均小于7,③丙溶液分别与其他四种溶液反应均生成沉淀,④甲溶液与丁溶液在加热条件下反应既产生白色沉淀又产生刺激性气味的气体,生成的白色沉淀不溶于稀硝酸。根据以上实验事实可以推断
A.甲为K2SO4溶液 B.乙为K2CO3溶液 C.戊为Fe(NO3)3溶液 D.丁为(NH4)2SO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com