
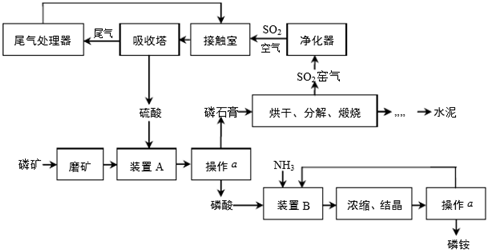
分析 (1)操作a是把固体与液体分开,应为过滤;接触室中净化气体可以防止催化剂中毒;
(2)装置a中磷酸与氨气发生反应,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4;
(3)SO2、微量的SO3和酸雾都能与碱反应,不能利用碱测定,SO2具有还原性,可以利用强氧化剂测定;尾气中SO2被氨水吸收生成(NH4)2SO3和水,(NH4)2SO3再H2SO4反应生成(NH4)2SO4和SO2,据此写出方程式;
(4)生产普通硅酸盐水泥的原料是石灰石和黏土;水泥中加入石膏可以提高水泥的硬化速度;
(5)Fe2(SO4)3•x(NH4)2SO4•yH2O的摩尔质量为(304+132x+18y)g/mol,则2.410gFe2(SO4)3•x(NH4)2SO4•yH2O中含有的NH4+的物质的量n=$\frac{2.41}{304+132x+18y}$×2xmol,加入过量的NaOH溶液并加热,生成的NH3的物质的量即=$\frac{2.41}{304+132x+18y}$×2xmol,生成的氨气用100mL0.0500mol•L-1硫酸吸收,再用0.2000mol•L-1的NaOH溶液滴定,生成正盐时消耗NaOH溶液25.00mL,故NH3消耗的H+的物质的量n=0.1L×0.05mol/L×2-0.025L×0.2mol/L=0.05mol,据此列式①;
2.410gFe2(SO4)3•x(NH4)2SO4•yH2O中含有的SO42-的物质的量n=$\frac{2.41}{304+132x+18y}$×(3+x)mol,与BaCl2溶液反应生成白色BaSO4沉淀2.330g中所含的SO42-的物质的量相等,据此列式②,两式联立即可解得.
解答 解:(1)分离固体和液体的方法是过滤,即操作a的名称为过滤;接触室中净化SO2气体可以防止催化剂中毒;故答案为:过滤;防止SO2气体中的灰尘、水蒸气等在接触室中导致催化剂中毒;
(2)装置a中磷酸与氨气发生反应,磷酸是三元酸,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4三种盐,其中(NH4)2HPO4、NH4H2PO4两种酸式盐.
故答案为:(NH4)2HPO4、NH4H2PO4;
(3)A、NaOH溶液与SO2、微量的SO3和酸雾反应,测量的SO2含量偏高,故A错误;
B、氨水NaOH溶液与SO2、微量的SO3和酸雾反应,测量的SO2含量偏高,故B错误.
C、硫酸尾气中只有SO2能被碘水氧化SO2,溶液颜色由蓝色变为无色,根据碘水溶液的体积结合方程式计算SO2的含量,故C正确;
D、硫酸尾气中只有SO2能被酸性KMnO4溶液氧化,溶液颜色由紫红色变为无色,根据KMnO4溶液的体积结合方程式计算SO2的含量,故D正确;
尾气中SO2被氨水吸收生成(NH4)2SO3和水,化学方程式为:SO2+2NH3•H2O=(NH4)2SO3+H2O;(NH4)2SO3再H2SO4反应生成(NH4)2SO4和SO2:(NH4)2SO3+H2SO4=(NH4)2SO4+SO2+H2O,故答案为:CD;SO2+2NH3•H2O=(NH4)2SO3+H2O,(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O;
(4)生产普通硅酸盐水泥的原料是石灰石即CaCO3和黏土;水泥中加入石膏可以提高水泥的硬化速度,故答案为:石灰石和黏土;调节水泥的硬化速度;
(5)Fe2(SO4)3•x(NH4)2SO4•yH2O的摩尔质量为(400+132x+18y)g/mol,则2.410gFe2(SO4)3•x(NH4)2SO4•yH2O中含有的NH4+的物质的量n=$\frac{2.41}{400+132X+18Y}$×2xmol,加入过量的NaOH溶液并加热,生成的NH3的物质的量n=$\frac{2.41}{400+132X+18Y}$×2xmol,生成的氨气用100mL0.0500mol•L-1硫酸吸收,再用0.2000mol•L-1的NaOH溶液滴定,生成正盐时消耗NaOH溶液25.00mL,故NH3消耗的H+的物质的量n=0.1L×0.05mol/L×2-0.025L×0.2mol/L=0.005mol,而根据反应NH3+H+=NH4+可知:$\frac{2.41}{400+132X+18Y}$×2xmol=0.005mol ①
2.410gFe2(SO4)3•x(NH4)2SO4•yH2O中含有的SO42-的物质的量n=$\frac{2.41}{400+132X+18Y}$(3+x)mol,与BaCl2溶液反应生成白色BaSO4沉淀2.330g,而2.33gBaSO4沉淀中所含的SO42-的物质的量n=$\frac{2.33g}{233g/mol}$=0.01mol,故有:$\frac{2.41}{400+132X+18Y}$×(3+x)mol=0.01mol ②
将①②联立可解得:x=1,y=24
即该硫酸盐的化学式为Fe2(SO4)3•(NH4)2SO4•24H2O.
故答案为:Fe2(SO4)3•(NH4)2SO4•24H2O.
点评 本题考查了工业尾气的处理的方法和化学方程式的书写以及化学式的求解,综合性较强,难度较大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
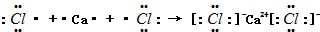 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原白色粉末的组成有3组可能 | |
| B. | 原白色粉末中一定含有CaCO3 | |
| C. | 原白色粉末中一定不含有CuSO4 | |
| D. | 若向无色滤液X中通入二氧化碳,产生白色沉淀,则可推断原白色粉末中一定还含有BaCl2、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
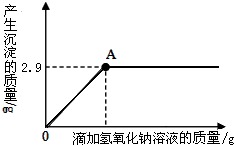 有一不纯的白色固体氯化镁中含有少量氯化钠.化学兴趣小组的同学为了测定该固体氯化镁中氯化钠的质量分数.进行了以下实验:称量10g样品置于烧杯中,向其中加入90g水,搅拌,使其完全溶解为止.然后取该溶液一半,往其中滴加10%的氢氧化钠溶液,产生沉淀的质量与所滴入氢氧化钠溶液的质量关系曲线如图所示.
有一不纯的白色固体氯化镁中含有少量氯化钠.化学兴趣小组的同学为了测定该固体氯化镁中氯化钠的质量分数.进行了以下实验:称量10g样品置于烧杯中,向其中加入90g水,搅拌,使其完全溶解为止.然后取该溶液一半,往其中滴加10%的氢氧化钠溶液,产生沉淀的质量与所滴入氢氧化钠溶液的质量关系曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1Na2SO3溶液中:c(OH-)=c(HSO3-)+c(H+)+c(H2SO3) | |
| B. | 1L0.1mol•L-1CuCl2溶液中:c(Cl-)=2c(Cu2+) | |
| C. | 物质的量浓度相等的Na2S和NaHS的混合溶液中:2c(Na+)=3c(S2-)+3c(HS-)+3c(H2S) | |
| D. | 室温时,向一定物质的量浓度的CH3COOH溶液中加入一定体积的氢氧化钠溶液,充分反应后溶液的pH=7,则反应后的溶液中:c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
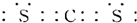
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和 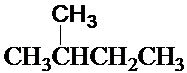
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com