
| A、0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(OH-)>c(H+) |
| B、0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D、在25℃100 mL NH4Cl溶液中:c(H+)=c(NH3?H2O)+c(OH-) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、该反应中肼作还原剂 |
| B、液态肼的标准燃烧热为641.6 kJ?mol-1 |
| C、该动力源的突出优点之一是生成物对环境无污染 |
| D、肼和过氧化氢反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+ |
| B、Al(OH)3 |
| C、AlO2- |
| D、Al3+和Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
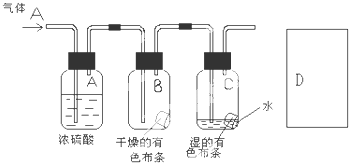
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(A)不随时间变化而变化 |
| B、混合气体的密度不随时间变化而改变 |
| C、VC(正)=2VB(逆) |
| D、混合气体的压强不随时间变化而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com