
已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2bkJ/mol
B.C2H2(g)+5/2O2(g)=2CO2(g)+ H2O(l) ΔH=2bkJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-4bkJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=bkJ/mol
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源:2015-2016学年浙江省温州十校联合体高二上学期期中测试化学试卷(解析版) 题型:选择题
一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g)  3C(g)+D(s),达到平衡时,C的浓度为ω mol/L。若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是
3C(g)+D(s),达到平衡时,C的浓度为ω mol/L。若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是
A.4molA+2molB B.3molC+2molD
C.1molB+3molC+1molD D.2molA+1molB+3molC+1molD
查看答案和解析>>
科目:高中化学 来源:2016届辽宁师范大学附属中学高三上学期期中考试化学试卷(解析版) 题型:选择题
用下列装置不能达到有关实验目的的是( )
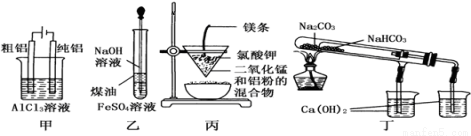
A.用甲图装置电解精炼铝
B.用乙图装置制备Fe(OH)2
C.用丙图装置可制得金属锰
D.用丁图装置验证NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源:2016届江西上高第二中学高三12月月考理科综合化学试卷(解析版) 题型:实验题
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。它易溶于水,难溶于乙醇,加热、易分解,在酸性溶液中不能稳定存在。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:

实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3·5H2O。
④再经过滤、洗涤、干燥,得到所需的产品。
(1) 步骤④中洗涤时,为了减少产物的损失用的试剂可以是 。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式表示原因 。
(3)写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式 。
(4)常用Na2S2O3溶液测定废水中Ba2+ 浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时全部转化为Cr2O72-;再加过量KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.0010 mol.L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如下表所示:
编号 | 1 | 2 | 3 | 4 |
消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
部分反应离子方程式为:
① Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O; ②I2+2S2O32-
2Cr3++3I2+7H2O; ②I2+2S2O32- 2I-+S4O62-。
2I-+S4O62-。
①判断达到滴定终点的现象是__ _____________
②从表格所给数据计算:一份待测溶液消耗Na2S2O3溶液的平均体积为 ml
③废水中Ba2+的物质的量浓度__________________。
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三第四次(12月)月考化学试卷(解析版) 题型:选择题
设NA 为阿伏加德罗常数的值。下列说法正确的是
A.0.1molN2与足量的H2反应,转移的电子数是0.6NA
B.常温下, 0.1 mol·L-1 NH4NO3溶液中含有的氮原子数是0.2NA
C.常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA
D.2.24 L CO和CO2的混合气体中所含的碳原子数为0.1 N A
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期第八次大考化学试卷(解析版) 题型:选择题
光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:

据此,下列判断中正确的是
A.该溶液中存在着SO2分子
B.该溶液中H+浓度是SO32-浓度的2倍
C.向该溶液中加入足量的酸SO2气体都能放出
D.向该溶液中加入NaOH可得到Na2SO3、NaHSO3和NaOH的混合溶液
查看答案和解析>>
科目:高中化学 来源:2016届广西柳州铁路第一中学高三上学期10月月考理化学试卷(解析版) 题型:填空题
I.X、Y是相邻周期、相邻主族的短周期元素,且原子序数X>Y.填写下列空白:
(1)若X为金属元素,Y为非金属元素,Y2H4是一种重要有机化工原料。
①X单质与Fe2O3反应时,每消耗13.5g X放热213kJ,该反应的热化学方程式是 ;
②写出实验室制备Y2H4的化学方程式 ;
(2)若X、Y元素的最高价氧化物的水化物都是强酸。
为防止YO2污染空气,科学家寻求合适的化合物G和催化剂,以实现反应:
YO2+G Y2+H2O+n Z(未配平,n可以为0)
Y2+H2O+n Z(未配平,n可以为0)
①上述反应式中的G不可能是 (填标号)。
A.NH3 B.CO C.CH3CH2OH
②25℃时,往a mol•L﹣1的YH3的水溶液(甲)中滴加0.01mol•L﹣1H2XO4溶液(乙),当甲与乙等体积混合时,溶液呈中性(设温度不变),甲中溶质的电离常数Kb= (用含a的代数式表示)。
Ⅱ.离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7﹣和AlCl4﹣组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
Ⅲ.甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.工业上可用CO和H2制取甲醇,化学方程式为:CO(g)+2H2(g)═CH3OH(g) △H=b kJ/mol,为研究平衡时CO的转化率与反应物投料比( )及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并绘出如图所示:
)及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并绘出如图所示:

(1)反应热b 0 (填“>”或“<”)。
(2)若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,A点的平衡常数KA= ,B点的平衡常数KB KA(填“>”或“<”或“=”)。
(3)为提高CO转化率可采取的措施是 、 (答出两条即可)。
查看答案和解析>>
科目:高中化学 来源:2016届浙江宁波效实中学高三上学期期中考试化学试卷(解析版) 题型:选择题
有关实验的叙述,正确的是
A.用瓷坩埚熔融氢氧化钠或碳酸钠
B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH
C.读取量筒内液体的体积,俯视读数导致读数偏大
D.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
查看答案和解析>>
科目:高中化学 来源:2016届北京市朝阳区高三上学期期中统考化学试卷(解析版) 题型:选择题
CO和H2在ThNi5作用下可以合成CH4。
已知温度为T时:① C O(g)+H2O(g) === CO2(g)+H2(g) ΔH=-41 kJ·mol-1
O(g)+H2O(g) === CO2(g)+H2(g) ΔH=-41 kJ·mol-1
② CH4(g)+2H2O(g) === 4H2(g) + CO2(g) ΔH=+165 kJ·mol-1
下列说法不正确的是
A.催化剂不能改变该反应的ΔH
B.①中反应物的键能总和小于生成物的键能总和
C.②中反应物的总能量高于生成物的总能量
D.CO(g)与H2(g)合成CH4(g)的反应为放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com