
 不变
不变 减小
减小

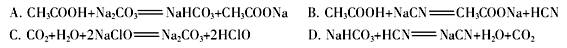

 离子的溶液中滴加NaOH溶液时, (填离子符号)先沉淀,
离子的溶液中滴加NaOH溶液时, (填离子符号)先沉淀, (填“>”、“二”或“<”)。
(填“>”、“二”或“<”)。 不变,正确;D、加水稀释,溶液中水的电离程度增大,溶液中
不变,正确;D、加水稀释,溶液中水的电离程度增大,溶液中 减小,正确;(3)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则有(0.3V1-0.1V2)·10-3=0.1(V1+V2)·10-3,可得V1∶V2=1∶1;②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得, A.若反应后溶液呈中性,则溶液中c(H+)=c(OH-)=1×10-7 mol?L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol?L-1,正确;B.如果二者体积相等,如果酸是强酸,则混合溶液呈中性,如果酸是弱酸,则混合溶液呈酸性,错误;C.若反应后溶液呈酸性,则溶液是酸和盐溶液,若酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,错误;D.若反应后溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,正确;选AD;(4)根据题给数据及盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,溶液的碱性越强判断,酸性强弱顺序是CH3COOH>H2CO3>HClO>HCN>HCO3—,①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是HCN,选A;②根据强酸制弱酸规律判断,下列反应可以成立的是AB;(5)当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,溶液中氢氧根的浓度逐渐增大,所需氢氧根浓度越小的离子越先沉淀,即pH小的离子先沉淀,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀,KSP[(Fe(OH)2]<KSP[(Mg(OH)2]。
减小,正确;(3)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则有(0.3V1-0.1V2)·10-3=0.1(V1+V2)·10-3,可得V1∶V2=1∶1;②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得, A.若反应后溶液呈中性,则溶液中c(H+)=c(OH-)=1×10-7 mol?L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol?L-1,正确;B.如果二者体积相等,如果酸是强酸,则混合溶液呈中性,如果酸是弱酸,则混合溶液呈酸性,错误;C.若反应后溶液呈酸性,则溶液是酸和盐溶液,若酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,错误;D.若反应后溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,正确;选AD;(4)根据题给数据及盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,溶液的碱性越强判断,酸性强弱顺序是CH3COOH>H2CO3>HClO>HCN>HCO3—,①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是HCN,选A;②根据强酸制弱酸规律判断,下列反应可以成立的是AB;(5)当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,溶液中氢氧根的浓度逐渐增大,所需氢氧根浓度越小的离子越先沉淀,即pH小的离子先沉淀,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀,KSP[(Fe(OH)2]<KSP[(Mg(OH)2]。

科目:高中化学 来源:不详 题型:单选题
A.K+、Na+、HSO 、Cl- 、Cl- |
B.Na+、Ba2+、[Al(OH)4]-、NO |
C.NH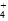 、K+、Cl-、NO 、K+、Cl-、NO |
| D.Fe2+、Na+、ClO-、S2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4种 | B.5种 | C.6种 | D.7种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NO3— | B.CO32—、NO3— |
| C.SO32—、NO3— | D.CO32—、NO3—、Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在强碱性溶液中:Na+、K+、AlO2-、Cl- |
| B.pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ |
| C.无色溶液中:Cu2+、NO3-、Cl-、H+ |
| D.无色溶液中: Na+、K+、ClO-、SO3 2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液: H2A+OH-
H2A+OH-查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.强碱性溶液中:K+、Al3+、Cl-、SO42- |
| B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- |
| C.含有0.1 mol·L-1 Ca2+溶液在中:Na+、K+、CO32-、Cl- |
| D.室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com