
下列叙述正确的是( )
A.用湿润的pH试纸测溶液的pH
B.用蒸馏法可将海水淡化为可饮用水
C.常温下浓硫酸不能盛放在铝制容器中
D.配制溶液时仰视容量瓶刻度线定容会使溶液浓度偏高
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014年高考化学指导冲关 第14练有机物的组成、结构和性质练习卷(解析版) 题型:选择题
反兴奋剂是每届体育赛事关注的热点。利尿酸是一种常见的兴奋剂,其分子结构如下:
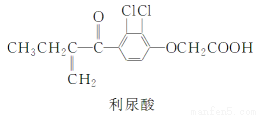
关于利尿酸的说法中,正确的是( )
A.它是芳香烃
B.它不能使酸性高锰酸钾溶液褪色
C.它不能与饱和碳酸钠溶液反应放出CO2
D.它能发生取代反应、加成反应和酯化反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第10练常见有机化合物及其应用练习卷(解析版) 题型:选择题
柑橘中柠檬烯的结构可表示为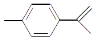 ,下列关于这种物质的说法中正确的是
,下列关于这种物质的说法中正确的是
( )
A.与苯的结构相似,性质也相似
B.可使溴的四氯化碳溶液褪色
C.易发生取代反应,难发生加成反应
D.该物质极易溶于水
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第10练常见有机化合物及其应用练习卷(解析版) 题型:选择题
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:
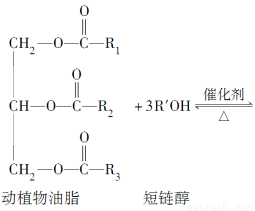

下列叙述错误的是( )
A.生物柴油由可再生资源制得
B.生物柴油是不同酯组成的混合物
C.动植物油脂是高分子化合物
D.“地沟油”可用于制备生物柴油
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(二) (解析版) 题型:选择题
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )
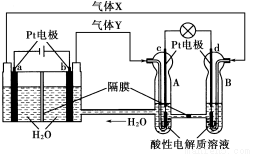
A.转移0.1 mol电子时,a电极产生1.12 L H2
B.b电极上发生还原反应
C.酸性电解质溶液中H+移向c电极
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(三) (解析版) 题型:实验题
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下:
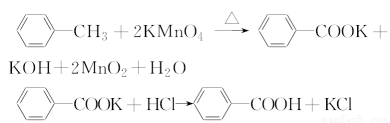
已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866 g·cm-3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3 g和6.9 g。
【制备产品】 30.0 mL甲苯和25.0 mL 1 mol·L-1高锰酸钾溶液在80℃下反应30 min,装置如图所示:

(1)图中支管的作用是_______________________。
(2)冷凝管的作用是________;进水口为________(填“a”或“b”)。
(3)相对于用酒精灯直接加热,用沸水浴加热的优点是________;在本实验中,三颈烧瓶最合适的容积是________(填字母)。
A.50 mL B.100 mL C.200 mL D.250 mL
【分离产品】他们设计如下流程分离粗产品苯甲酸和回收甲苯:
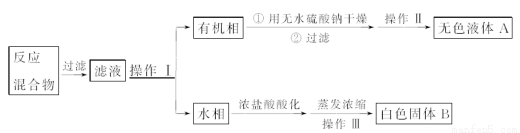
(4)操作Ⅰ的名称是________;含有杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是________。
(5)操作Ⅲ的名称是________。检验B中是否含有Cl-的方法如下:取少量B溶于水,在上层清液中滴加稀硝酸酸化的________溶液,若产生白色沉淀,则B中含有Cl-。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(三) (解析版) 题型:选择题
下列离子在指定条件下一定能大量共存的是( )
A.含有大量OH-的溶液中:CO32-、Cl-、F-、K+
B.与铝反应产生氢气的溶液中:Na+、AlO2-、NO3-、HCO3-
C.含有大量Al3+的溶液中:K+、Na+、NO3-、ClO-
D.使甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:填空题
近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下:

(1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)_______________________________________________________________。
(2)KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________________________________。
(3)第④步通入CO2,可以使MnO42-发生反应,生成MnO4-和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为____________________(精确到0.1%)。
(4)第⑤步趁热过滤的目的是________________________________。
(5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、___________、洗涤、干燥。干燥过程中,温度不宜过高,因为_________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练1 化学基本概念练习卷(解析版) 题型:填空题
食品安全是社会关注的热点。市场上已检测出一些矿泉水中含有高浓度的致癌物“溴酸盐”,而这个“行业秘密”在人们的眼皮底下被隐藏了10多年。实验室中制备“溴酸盐”过程如下:
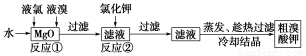
根据上述转化关系回答下列问题:
(1)反应①的化学方程式为______________________________。
(2)已知反应②是复分解反应,该反应的化学方程式为_____________________________。
(3)已知在酸性条件下溴酸盐可发生如下离子反应:
Ⅰ.2BrO3-+10Cl-+12H+=5Cl2↑+Br2+6H2O
Ⅱ.6BrO3-+5Cl-+6H+=5ClO3-+3Br2+3H2O
Ⅲ.BrO3-+5Br-+6H+=3Br2+3H2O
①上述反应所涉及的粒子中,氧化性最强的是________。
②在KCl和KBr的酸性混合溶液中,加入过量的KBrO3,其氧化产物为________,还原产物为________。
③将12 mL 0.4 mol·L-1 KBrO3溶液和10 mL 0.6 mol·L-1 KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com