
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
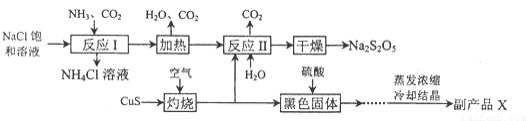
已知:反应II包含2NaHSO3=Na2S2O5+ H2O等多步反应。
(1)反应I的总化学方程式为 ,反应I进行时应先通入的气体是 ,反应I产生的NH4Cl可用作________。
(2)灼烧时发生反应的化学方程式为 ,若灼烧时生成SO21.12×l06 L(标准状况下),则转移电子 mol。
(3)己知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为 。
(4)副产品X的化学式是 ,在上述流程中可循环使用的物质是____。
(5)为了减少产品Na2S205中杂质含量,需控制反应II中气体与固体的物质的量之比约为 ,检验产品中含有碳酸钠杂质所需试剂 。(填编号)。
①澄清石灰水 ②饱和碳酸氢钠溶液 ③氢氧化钠 ④酸性高锰酸钾 ⑤稀硫酸
科目:高中化学 来源:2015-2016学年浙江省温州十校联合体高一上学期期中测试化学试卷(解析版) 题型:选择题
已知aAm+与bBn-具有相同的核外电子排布,则下列关系正确的是
A. a=b+m+n B. a=b-m+n C. a=b+m-n D. a=b-m-n
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第三次考试化学试卷(解析版) 题型:填空题
H、C、N、O、Fe、Si、I是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示___________________。
(2)若FeSO4和O2的系数比为2:1,试配平下列方程式:__FeSO4+__K2O2→__K2FeO4+__K2O+__K2SO4+__O2↑
(3)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOX)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:NO2+NO+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
现有一NO与NO2的混合气体,将其通入50mL 2mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3― 0.02mol。
①所得溶液中NaNO2的物质的量为 mol;
②混合气体中V(NO):V(NO2)= 。
(4)向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)的变化可用下图简单表示
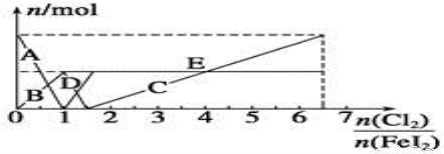
①当n(Cl2)∶n(FeI2)=6.5时,溶液中n(Cl-)∶n(IO3-)= 。
②当n(Cl2)∶n(FeI2)=1.2时,离子方程式可表示为 。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三第四次(12月)月考化学试卷(解析版) 题型:选择题
下列有关化学用语表述正确的是
A.S2-的结构示意图:
B.Na2S的电子式:
C.邻羟基苯甲酸的结构简式:
D.质子数与中子数相等的硫原子: S
S
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期第八次大考化学试卷(解析版) 题型:实验题
化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:

I.图A为教材制备乙酸乙酯的实验装置,甲同学认为图B装置比A要好,则冷却水应从_______口进入;乙同学认为图C装置效果更好,理由是________________。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)【提出猜想】小组同学认为分解产物可能有以下几种情况:
A.Fe2O3 SO2 NH3 H2O B.FeO SO3 NH3 H2O
C.FeO SO2 NH3 H2O D.Fe2O3 SO3 SO2 NH3 H2O
根据所学知识,可确定______________不成立(填序号)
(2)【药品验纯】甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和__________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加______________(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)【实验探究】为检验分解产物,甲同学设计了如下实验装置。

①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是__________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为_____。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含_______。
(4)【实验结论与反思】通过实验现象和认真反思,上述猜想中一定正确的是_________(填序号)。
查看答案和解析>>
科目:高中化学 来源:2016届广西柳州铁路第一中学高三上学期10月月考理化学试卷(解析版) 题型:选择题
已知X、Y、Z、W、R是原子序数依次增大的五种短周期主族元素,其中Y、R原子最外层电子数相等;X元素最低负价与W元素最高正价绝对值相等;工业上常用电解熔融氧化物的方法冶炼W单质;Z、W、R最高价氧化物对应的水化物两两反应均生成盐和水。下列说法正确的是( )
A. 简单离子半径:Y>Z>W
B. 简单氢化物的热稳定性:X>Y>R
C. W的最高价氧化物对应的水化物碱性比Z的强
D. R的最高价氧化物对应的水化物化学式一定是HRO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:实验题
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中
定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_____作指示剂。
(3)读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
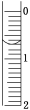
(4)滴定。滴定终点的现象是__________________________________________。
Ⅱ.数据记录:
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) (mL) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) (mL) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理:
某同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4 mL=15.24 mL。
(5)指出他的计算的不合理之处:__________;按正确数据处理,可得市售白醋总酸量=_____g/100 mL。(结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源:2016届陕西西安第一中学高三上学期期中考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、FE2+、Cl-、SO42-
B.饱和氯水中:NH4+、SO32-、SO42-、Cl-
C.C(H+)=1.0×10-13mol/L溶液中:K+、NA+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:NA+、K+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次联考化学试卷(解析版) 题型:填空题
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。回答下列问题:
(1)基态铜原子的电子排布式为 ;已知高温下CuO—→Cu2O+O2,试从铜原子价层电子结构变化角度解释这一反应发生的原因:________________________。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ,若“Si-H”中键合电子偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为________________。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3.NH3,BF3.NH3中B原子的杂化轨道类型为____,B与N之间形成 键。
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为 ,在SiC中,每个C原子周围最近的C原子数目为 ,若晶胞的边长为a pm,则金刚砂的密度为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com