

分析 (1)甲装置中铜与浓硫酸加热反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)二氧化硫具有漂白性,能够使品红溶液褪色;二氧化硫有毒,多余的二氧化硫需要用碱液吸收;二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水.
解答 解:(1)铜与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O;
(2)由于二氧化硫具有漂白性,则反应后品红溶液会褪色;二氧化硫是一种有毒气体,则盛放品红溶液的试管口放一团浸有碱液的棉花的作用是吸收SO2,防止污染空气,反应的化学方程式为:2NaOH+SO2=Na2SO3+H2O,
故答案为:褪色;吸收SO2,防止污染空气;2NaOH+SO2=Na2SO3+H2O.
点评 本题考查了浓硫酸的性质、二氧化硫的性质及检验,题目难度中等,注意掌握浓硫酸的性质,明确二氧化硫的性质及检验方法,试题培养了学生的分析能力及灵活应用基础知识的能力.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②③⑧ | C. | ③④⑤⑦⑧ | D. | ②⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物分子中C、H、O原子个数比为1:2:3 | |
| B. | 该有机物中必定含有氧元素 | |
| C. | 该有机物分子中C、H原子个数比为1:2 | |
| D. | 该有机物化学式为C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可以使Br2水褪色,是因为SO2具有漂白性 | |
| B. | Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | Fe在Cl2中燃烧生成FeCl3,故Fe与I2反应生成FeI3 | |
| D. | 可以用铝制的容器储存和运输浓硝酸是因为常温下铝遇到浓硝酸钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素R位于周期表中第ⅤA族 | |
| B. | R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1mol RO3-参与该反应,则转移的电子的物质的量为5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
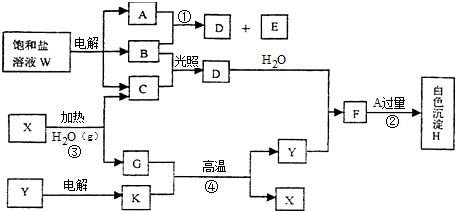
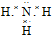 ,B的晶体类型是分子晶体.
,B的晶体类型是分子晶体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com