
����Ŀ��ij��ԭ�ӵ�������ag��һ��12Cԭ�ӵ�������bg����NAֻ��ʾ�����ӵ����̵���ֵ��������˵������ȷ���ǣ���
������ԭ�ӵ����ԭ������Ϊ12a/b
��m g����ԭ�ӵ����ʵ���Ϊm/aNA mol
������ԭ�ӵ�Ħ��������aNAg/mol
�� ag����ԭ�������ĵ�����Ϊ16
��cg ����ԭ������������Ϊ4bcNA/3a
A���٢ڢۢܢ� B���٢ڢۢ� C���٢ڢܢ� D���٢ۢܢ�
���𰸡�A
��������
���������������ԭ�ӵ����ԭ������=![]() ��
��![]() ����ȷ����1mol̼ԭ�ӵĸ�����NA��n=
����ȷ����1mol̼ԭ�ӵĸ�����NA��n=![]() =
=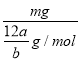 ��
��![]() mol����ȷ����Ħ����������ֵ�ϵ��������ԭ��������Ҳ����1molԭ�Ӻ��е����������Ը���ԭ�ӵ�Ħ��������aNA g/mol����ȷ����a g����ԭ�ӵĸ���=
mol����ȷ����Ħ����������ֵ�ϵ��������ԭ��������Ҳ����1molԭ�Ӻ��е����������Ը���ԭ�ӵ�Ħ��������aNA g/mol����ȷ����a g����ԭ�ӵĸ���=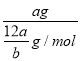 NA��
NA��![]() NA��һ����ԭ���к���16�����ӣ�����a g����ԭ�������ĵ�����Ϊ
NA��һ����ԭ���к���16�����ӣ�����a g����ԭ�������ĵ�����Ϊ![]() NA���������ڸ���ԭ�ӵ�������a g����ag����ԭ����ĿΪ1�����ʺ��е�����ĿΪ16����ȷ����cg ����ԭ������������Ϊ
NA���������ڸ���ԭ�ӵ�������a g����ag����ԭ����ĿΪ1�����ʺ��е�����ĿΪ16����ȷ����cg ����ԭ������������Ϊ![]() ����ȷ����ѡA��
����ȷ����ѡA��


 �����ܾ�ϵ�д�
�����ܾ�ϵ�д� ���ƿ�����ϵ�д�
���ƿ�����ϵ�д� ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�ͽ�����ķ����ǣ� ��
A.���������
B.����ζ
C.����
D.���ݷ�ɢ����ֱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʣ��ٿ��� ��O2 ��NaHSO4 �ܰ�ˮ ��CuSO45H2O ��NaOH ��CO2 ��Fe2O3 ����ʯ ��H2SO4 �� ��ش��������⣨���ں�������д��ţ���
��1�����ڻ���������
��2���������������������
��3�����ڼ������
��4��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ȼ�ϵ����CsHSO4����Ϊ����ʴ���H+��������ṹ����ͼ������ܷ�Ӧ�ɱ�ʾΪ��2H2 + O2 = 2H2O�������й�˵����ȷ����
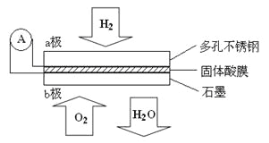
A������ͨ�����·��b������a��
B��b���ϵĵ缫��ӦʽΪ��O2+2H2O +4e��=4OH��
C��ÿת��0.1mol���ӣ�����1.12L��H2
D��H+��a��ͨ�����������ʴ��ݵ�b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������˳���ˮ���ᷴӦ��ͷʹ��ѣ�Ρ����ġ�������ʱ��ҽ���ɲ�ȡ�ھ�����ע���������������� ��
A��1��25%NH4Cl B��0��9%NaHCO3 C��75%�ƾ� D��10%����ù��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe��Cu������Ҫ�Ľ���Ԫ�ء�����˵����ȷ����(����)
A. ���ߵĵ��ʷ����ڿ����о�ֻ����������
B. ���ߵĵ��ʶ�����ϡ���ᷴӦ��������
C. ���������£����ֽ��������ܽ���Ũ������
D. �Ʊ�FeCl3��CuCl2�������ܲ��ý�����Һֱ�����ɵķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ50.0mL��̼���ƺ������ƵĻ����Һ����������Ȼ�����Һ��õ�14.51g��ɫ�������ù���ϡ���ᴦ������������ٵ�4.66g����������ų����Լ��㣺
(1)ԭ���Һ��̼���ƺ������Ƶ����ʵ���Ũ�ȡ�
(2)�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ϊ��ѹ��������Ϊ������������ͬ�����³�������ʵ���NO2���壬����ʼʱ�����ͬ��������Ӧ��2NO2��g��![]() N2O4��g�� ��H��0��һ��ʱ�����ﵽƽ��״̬������˵������ȷ����
N2O4��g�� ��H��0��һ��ʱ�����ﵽƽ��״̬������˵������ȷ����
A. ƽ��ʱNO2����������ף���
B. �ﵽƽ������ʱ�䣬���������
C. �÷�Ӧ��ƽ�ⳣ������ʽK��c��N2O4��/c��NO2��
D. ���������������ѹǿ���ֲ��䣬��˵����Ӧ�Ѵﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA(g)��3B(g)===2C(g)��2D(g)�����ֲ�ͬ����µķ�Ӧ�������£����б�ʾ��Ӧ����������(����)
A. v(A)��0.15 mol��L��1��min��1
B. v(B)��0.01 mol��L��1��s��1
C. v(C)��0.40 mol��L��1��min��1
D. v(D)��0.45 mol��L��1��min��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com