
| c(OH-) |
| c(H+) |
| c(OH-) |
| c(H+) |
| A、溶液中水电离出的c(H+)=10-10mol/L |
| B、该溶液中醋酸的电离度为1% |
| C、溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大 |
| D、溶液中c(H+)+c(CH3COO-)=0.1 mol/L |
| c(OH-) |
| c(H+) |
| c(OH-) |
| c(H+) |
| 10-3 |
| 0.1 |


科目:高中化学 来源: 题型:
| 弱酸 | 电离常数 | 弱酸 | 电离常数 |
| H2CO3 | K1=4.4x 10-7 K2=4.7x 10-11 |
CH3COOH | K=1.75x 10-5 |
| H2SO3 | K1=1.54x 10-2 K2=1.01x 10-7 |
H2C2O4 | K1=5.4x 10-2 K2=5.4x 10-5 |
| A、上述四种酸的酸性强弱顺序为:H2C2O4>H2SO3>CH3COOH>H2CO3 |
| B、物质的量浓度相等的CH3COONa、NaHCO3两溶液中:c(CH3COO-)>c(HCO3-) |
| C、0.1mol/L NaHSO3溶液中的电荷守恒表达式:c(Na+)+c(H+)=c(HSO3-)+2 c(SO32-)+c(OH-) |
| D、0.1mol/L NaHC2O4溶液中c(Na+)、c(HC2O4-)、c(OH-)、c(H+)的大小顺序为:c(Na+)>c(HC2O4-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
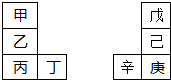 甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A、金属性:甲>乙>丁 |
| B、原子半径:辛>己>戊 |
| C、丙与庚的原子核外电子数相差13 |
| D、乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的性质随着原子序数的递增而呈周期性变化 |
| B、随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现 |
| C、随着元素原子序数的递增,元素的最高化合价从+1到+7,最低化合价从-7到-1重复出现 |
| D、元素性质的周期性变化是指相对原子量的周期性变化、原子半径的周期性变化及元素主要化合价的周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:H2SiO3<H2SO4<HClO4 |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、稳定性:HCl>H2S>PH3 |
| D、还原性:F->Cl->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:

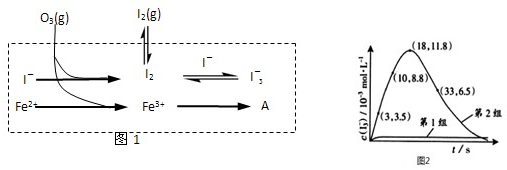
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
| 开始沉淀pH | 完全沉淀pH | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.87 | 3.87 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com