
| A. | 所含质子数=Z-n | B. | 所含中子数=A-Z+n | ||
| C. | 质量数=A+n | D. | 所含电子数=Z+n |
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3-CH═CH2和CH2═CH2的最简式相同 | |
| B. | 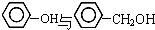 相差一个CH2,互为同系物 相差一个CH2,互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的乙炔、苯、苯乙烯(C8H8)分别完全燃烧,耗氧量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙基(-CH2CH3) | B. | 碳正离子[(CH3)3C+] | C. | 乙炔 (C2H2) | D. | 羧基 (-COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中有七行,七个周期,有18列,18个族 | |
| B. | 目前使用的元素周期表中,同一主族的元素最外层电子数相同 | |
| C. | 短周期元素是指1~20号元素,其中大多数为非金属 | |
| D. | 元素周期表中,元素的种数与对应的原子种数一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
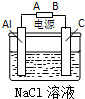 甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.
甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.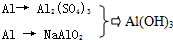
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
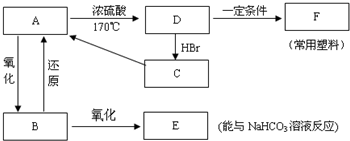
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
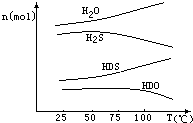 我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L-1.其工业提取法有:
我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L-1.其工业提取法有:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
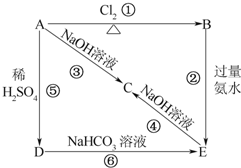 图示中,E是不溶于水的白色胶状物质.
图示中,E是不溶于水的白色胶状物质.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com