
| A. | CH4分子的比例模型: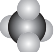 | B. | CO2的电子式:O::C::O | ||
| C. | Cl-的离子结构示意图: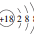 | D. | 中子数为18的硫原子:${\;}_{16}^{18}$S |
分析 A.比例模型表示原子的相对大小及原子连接顺序,直观地表示分子的形状.注意碳原子的成键情况主要根据与碳原子形成共价键的原子的数目确定;
B.二氧化碳为共价化合物,分子中存在两个碳氧双键,该电子式中漏掉了氧原子的2对孤电子对;
C.氯原子得电子形成氯离子;
D.元素符号左下角数字表示质子数、左上角数字表示质量数.
解答 解:A.由比例模型可以看出分子中有1个碳原子和4个氢原子,分子大小与甲烷的空间结构相符合,故A正确;
B.二氧化碳分子中存在两个碳氧双键,C、O原子最外层都达到8电子稳定结构,二氧化碳正确的电子式为: ,故B错误;
,故B错误;
C.Cl-的离子结构示意图: ,故C错误;
,故C错误;
D.元素符号左下角数字表示质子数、左上角数字表示质量数,所以中子数为18的硫原子质量数为34,表示为:1634S,故D错误.
故选A.
点评 本题考查了常见化学用语的书写方法,题目难度中等,涉及原子结构示意图、电子式、比例模型、元素符号等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生规范答题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 加水稀释,氨水溶液中导电粒子的数目减少 | |
| B. | 通入HCl气体,氨水溶液中NH3•H2O的电离平衡向右移动,溶液的pH增大 | |
| C. | 由0.1mol/L一元碱BOH溶液的 pH=10,可推知BOH溶液中存在BOH═B++OH- | |
| D. | 由0.1mol/L一元酸HA溶液的 pH=3,可推知NaA溶液中存在A-+H2O═HA+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素和淀粉遇碘水均呈蓝色 | |
| B. | 油脂可用来制造肥皂 | |
| C. | 石油分馏得到的汽油是纯净物 | |
| D. | 煤的气化属于物理变化,煤的干馏属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子比例模型: | B. | NH4I的电子式: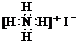 | ||
| C. | 乙醇的结构简式:C2H5OH | D. | K+最外层电子排布式:4S24P6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Fe3+易水解,它的水解产物之一能抑制的Fe2+水解 | |
| B. | Fe2+有较强的还原性,它能还原Fe3+ | |
| C. | Fe3+有较强的氧化性,它能氧化Fe2+ | |
| D. | Fe3+的水解是吸热反应,升温能促进它的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | c(HCO${\;}_{3}^{-}$) | ||
| C. | c(H+)•c(OH-) | D. | $\frac{c(O{H}^{-})•c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XYZ | B. | X2YZ | C. | X2Y2Z4 | D. | X2YZ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com