
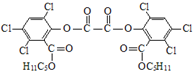 “魔棒”常用于晚会气氛的渲染,其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后发光.草酸二酯(CPPO)结构简式如下图所示,请回答下列问题:
“魔棒”常用于晚会气氛的渲染,其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后发光.草酸二酯(CPPO)结构简式如下图所示,请回答下列问题: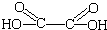 ).
). )在催化剂和适当条件下可以生成CPPO,
)在催化剂和适当条件下可以生成CPPO,| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(S) | ||
| C(mo•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
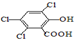
 .类似的
.类似的 ,也可以发生反应生成N,则N结构简式为
,也可以发生反应生成N,则N结构简式为 (写出其中的一种).
(写出其中的一种). 分析 (1)草酸(乙二酸)中只有2个C,含2个COOH;
(2)CPPO中含-Cl、-COOC-,结合苯、卤代烃、酯的性质分析;
(3)a、①酸性高锰酸钾溶液具有强氧化性,能够将草酸氧化,据此写出反应的离子方程式;
②对比试验1和试验2的反应条件的区别,可以得出影响化学反应速率的因素;
b、①先书写戊基-C5H11异构体,戊基异构数目等于戊醇的异构体数目;
c、①与 具有相同种类和数目的官能团的同分异构体即移动官能团的位置不同而形成的位置异构;
具有相同种类和数目的官能团的同分异构体即移动官能团的位置不同而形成的位置异构;
②由信息可知,酚-OH的邻位易被取代,则 中-OH的邻位被取代生成N,N氧化生成M,所以
中-OH的邻位被取代生成N,N氧化生成M,所以 与(CH3)2C=CH2发生加成的反应生成N
与(CH3)2C=CH2发生加成的反应生成N
解答 解:(1)草酸(乙二酸)中只有2个C,含2个COOH,结构简式为HOOC-COOH(或HOOCCOOH、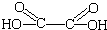 ),
),
故答案为:HOOC-COOH(或HOOCCOOH、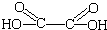 );
);
(2)CPPO中含-Cl、-COOC-,且含有苯环,
A.草酸二酯中含苯环,是芳香化合物,故A正确;
B.含-COOC,且水解生成羧基和苯酚结构均与NaOH反应,则1mol草酸二酯最多可与6mol NaOH反应,故B错误;
C.含2个苯环与氢气发生加成反应,则1mol草酸二酯在铂催化下最多可与6mol H2加成,故C正确;
D.草酸二酯的分子式为C26H24O8Cl6,故D错误;
故答案为:AC;
(3)a、①酸性高锰酸钾具有强氧化性,草酸能够被氧化,导致酸性高锰酸钾溶液褪色,反应的离子方程式为:5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O;
②通过两组实验比较知,其它条件相同,试验2中加入硫酸锰,其反应时间短,说明反应速率快,从而证明反应生成的Mn2+有催化作用,加快了反应速率,
故答案为:生成的Mn2+对此反应起催化剂的作用;
b、①戊基-C5H11可能的结构有:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-C(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,则戊醇的可能结构有8种;这些同分异构体发生消去反应后所得的烯烃有:CH2=CHCH2CH2CH3(无顺反异构)、CH3CH=CH2CH2CH3(有顺反异构)、CH2=C(CH3)CH2CH3、(CH3)2C=CH2CH3、(CH3)2CHCH=CH2.故形成的烯烃共有6种.
故答案为:8;6;
c、①与 具有相同种类和数目的官能团的同分异构体即位置异构,即移动3个-Cl、1个-OH和1个-COOH在苯环上的位置所形成的异构,共有8种,故答案为:8;
具有相同种类和数目的官能团的同分异构体即位置异构,即移动3个-Cl、1个-OH和1个-COOH在苯环上的位置所形成的异构,共有8种,故答案为:8;
②由信息可知,酚-OH的邻位易被取代,则 中-OH的邻位被取代生成N,N氧化生成M,所以
中-OH的邻位被取代生成N,N氧化生成M,所以 与(CH3)2C=CH2发生加成的反应生成N,则N为
与(CH3)2C=CH2发生加成的反应生成N,则N为 ,
,
故答案为: .
.
点评 本题以合成的有机物考查其结构与性质,为高频考点,把握结构中官能团与性质的关系为解答的关键,侧重烯烃、醇、酯等有机物性质的考查,注意同分异构体的书写及有机反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 通入二氧化碳气体 | B. | 加水稀释 | ||
| C. | 通入氯化氢气体 | D. | 加入饱和石灰水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=8的NaB溶液中:c(Na+)>c(B-)>c(OH-)>c(H+) | |
| C. | 物质的量浓度相等的①CH3COONH4、②NH4Cl、③NH4HSO4三种溶液中:c(NH4+)大小顺序①=②>③ | |
| D. | 常温下.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL(反应后溶液的总体积为两反应液体积之和) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
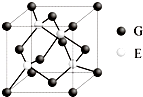 现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大.A的原子半径最小;B的原子有6个运动状态不同的电子;D、E两元素同主族,且E的原子核外电子数是D的2倍;F是前四周期中未成对电子数最多的元素;G原子内层轨道全排满电子,最外层电子数为2.根据以上信息,回答下列问题:
现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大.A的原子半径最小;B的原子有6个运动状态不同的电子;D、E两元素同主族,且E的原子核外电子数是D的2倍;F是前四周期中未成对电子数最多的元素;G原子内层轨道全排满电子,最外层电子数为2.根据以上信息,回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4 | B. | CuO | C. | CuSO4•5H2O | D. | Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国规定商家不得无偿提供塑料袋,目的是减少“白色污染” | |
| B. | 乙醇是一种易燃烧污染小的可再生能源,但只能在实验室内作燃料 | |
| C. | 化石燃料不可再生,使用太阳能代替化石燃料,有利于节约资源、保护环境 | |
| D. | 积极开发废电池的综合利用技术,防止其中的重金属盐对土壤和水源造成污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com