
已知一个碳原子连两个—OH的结构不稳定,会很快脱去一分子水,其变化如下:
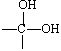 →
→ 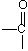 + H2O
+ H2O
下图中B和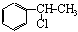 、
、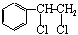 等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳。过程中一些小分子都已经略去。
等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳。过程中一些小分子都已经略去。
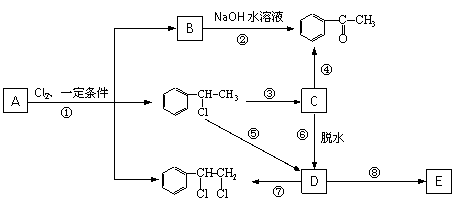 |
(1)A的化学名称为___ _
(2)第④步的化学方程式为__________,该反应类型为_____;
(3)第⑦步的化学方程式为__________,该反应类型为_____;
(4)E的结构简式为______;
(5)符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢的C的同分异构体的结构简式分别是 、 、 。
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.需要加热才能发生的反应一定是吸热反应。
B.任何放热反应在常温条件下一定能够发生。
C.反应物和生成物所具有的总能量的差决定了化学反应是放热还是吸热。
D.构成物质微粒间的化学键键能越小,该物质的能量就越低,物质越稳定。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于3Cl2 + 6KOH  KClO3 + 5KCl + 3H2O反应,以下说法错误的是
KClO3 + 5KCl + 3H2O反应,以下说法错误的是
A.Cl2既是氧化剂,又是还原剂
B.3 mol氯气参加反应转移5 mol电子
C.氧化产物的物质的量是还原产物的物质的量的5倍
D.每有1 mol原子被氧化的同时就有5 mol原子被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
把质量为m g的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红,而且质量仍为m g的是( )
A. 稀H2SO4 B. C2H5OH C. 稀HNO3 D. CH3COOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
据调查,劣质的家庭装饰材料会释放出近百种能引发疾病的有害物质,其中一种有机物分子的球棍模型如右图,图中“棍”代表单键或双键或三键,不同大小的球代表不同元素的原子,且三种元素位于不同的短周期。下面关于该有机物的叙述不正确的是( )
A.有机物化学式为C2HCl3
B.分子中所有原子在同一平面内
C.该有机物难溶于水
D.可由乙炔与氯化氢加成得到
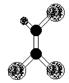
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是
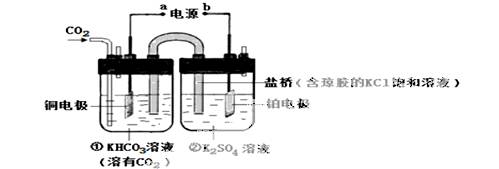
A.该过程是电能转化为化学能的过程
B.一段时间后,①池中n(KHCO3)不变
C.一段时间后,②池中溶液的pH 一定下降
D.铜电极的电极反应式为CO2+8H++8e- = CH4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
 CO(NH2)2+ 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
CO(NH2)2+ 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
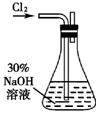
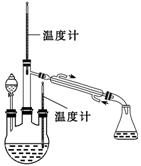
实验一: 制备NaClO溶液。(实验装置如右图所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2) 锥形瓶中发生反应的化学方程式是 。
 (3) 因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液的NaOH的浓度。请选用所提供的试剂(H2O2溶液、FeCl2溶液、0.1000mol·L-1盐酸、酚酞试液),设计实验方案。
(3) 因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液的NaOH的浓度。请选用所提供的试剂(H2O2溶液、FeCl2溶液、0.1000mol·L-1盐酸、酚酞试液),设计实验方案。
。
实验二: 制取水合肼。(实验装置如右图所示)
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。
加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。
(已知:N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl)
(4)分液漏斗中的溶液是 (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
(已知:N2H4·H2O + 2I2 = N2↑+ 4HI + H2O)
(5)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 。
(6)实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述中,正确的是( )
|
| A. | 容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液 |
|
| B. | 用分液的方法分离水和酒精的混合物 |
|
| C. | 配制1L0.1mol/L的NaCl溶液时可用托盘天平称量5.85gNaCl固体 |
|
| D. | 用滴管滴加液体时,为防止液滴飞溅,滴管紧贴试管内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在t℃下,某反应达到平衡,平衡常数K=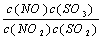 。恒容时,温度升高,NO浓度减小。下列说法正确的是 ( )
。恒容时,温度升高,NO浓度减小。下列说法正确的是 ( )
A.该反应的焓变为正值 B.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度
C.升高温度,逆反应速率减小 D.该反应化学方程式为:NO+SO3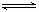 NO2+SO2
NO2+SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com