
四氯化锡常用于染色的媒染剂等,工业上常用氯气与金属锡反应制备四氯化锡。已知SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发烟。实验室可用下列装置合成四氯化锡(夹持装置略)。

(1)装置D的名称为 ;
(2)冷凝水应从 (填“a”或“b”)口进入F中;
(3)装置A中固体B为黑色粉末,写出烧瓶中发生反应的化学反应方程式为 ;
(4)假设没有装置C,在D中除生成SnCl4外,可能得到的副产物为 ;
(5)装置E中加热的目的是 、 ;
(6)装置H中盛放足量的FeBr2溶液可吸收尾气中的氯气,其反应的离子反应方程式为 。
(7)该实验装置存在设计缺陷,你的改进措施为 。
(8)若装置A中标准状况下生成6.72L气体,假设不计气体损耗且Sn足量,反应完毕后在G 中锥形瓶里收集到37.20 g SnCl4,则SnCl4的产率为 (已知SnCl4相对分子质量为261)。
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源:2016届山西省忻州市高三上学期第一次月考化学试卷(解析版) 题型:选择题
分第枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是
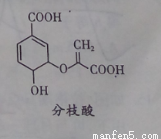
A.在与氢气加成时最多消耗5molH2
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省佛山市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验“实验操作”与“结论”对应关系正确的是
选项 | 实验操作 | 结论 |
A | 向Fe(NO3)2溶液的试管中加入稀H2SO4 ,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
B | 向沸水中逐滴加入1~2 mL FeCl3饱和溶液,煮沸至红褐色液体 | 制备Fe(OH)3胶体 |
C | 常温下,向饱和 | 说明常温下
|
D | 向纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年青海省高一入学化学试卷(解析版) 题型:选择题
下列物质的水溶液能导电,但属于非电解质的是
A.H2SO4 B.Cl2 C.NaAlO2 D.SO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省太原市高一上入学考试化学试卷(解析版) 题型:选择题
鉴别下列各组物质所用的试剂或方法不正确的是( )
A、硬水、软水(肥皂水)
B、稀盐酸、食盐水(酚酞试液)
C、涤纶、羊毛制品(点燃)
D、空气、氧气(带火星的木条)
查看答案和解析>>
科目:高中化学 来源:2016届贵州省贵阳市高三8月摸底考试化学试卷(解析版) 题型:填空题
(14分)X、Y、Z、W、R均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子的3d轨道为半充满状态,新制备的R的氢氧化物悬浊液可用于检验醛基的存在。请回答下列问题:
(1)X2分子中σ键和π键数目比是 ;
(2)R的晶胞结构如图所示,该晶胞中所含的原子个数是 ;
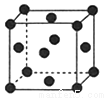
(3)下列有关X、Y、W的说法正确的是 ;
①第一电离能的排序是Y>X>W
②常温下,Y的氢化物分子间存在氢键
③XY3一中X的杂化轨道类型为sp3杂化
④W属于d区的元素
(4)X的气态氢化物分子的空间构型为 ,将其水溶液滴入R的氢氧化物悬浊液中,反应的离子方程式为 ;
(5)将Na2Y2与W2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省贵阳市高三8月摸底考试化学试卷(解析版) 题型:选择题
一些烷烃的标准燃烧热如下表:
化合物 | 标准燃烧热(△H/KJ·mol-1) | 化合物 | 标准燃烧热(△H/KJ·mol-1) |
甲烷 | -891.0 | 正丁烷 | -2878.0 |
乙烷 | -1560.8 | 异丁烷 | -2869.6 |
丙烷 | -2221.5 | 2-甲基丁烷 | -3531.3 |
下列说法正确的是
A.热稳定性:正丁烷>异丁烷
B.正戊烷的标准燃烧热大约为:△H=一3540kJ/mol
C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)→4CO2(g)+6H2O(g)+1560.8kJ/mol
D、在101kPa下,甲烷的热值是891.0kJ/g
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省合肥市高二上开学考试化学试卷(解析版) 题型:选择题
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是
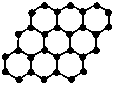
A.石墨烯与石墨互为同位素
B.0.12g石墨烯中含有6.02×1022个碳原子
C.石墨烯是一种有机化合物
D.石墨烯中的碳原子间以共价键结合
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三9月调考化学试卷(解析版) 题型:填空题
(9分)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
写出由磷酸钙矿制取白磷总的反应方程式____________。
(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体 (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在 之间(已知磷酸的各级电离常数为:K1 = 7.1×10?3 K2 = 6.3×10?8 K3 =4.2×10?13 lg7.1≈0.9 lg6.3≈0.8 lg4.2≈0.6) 。Na2HPO4 溶液显碱性,若向其溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O= 20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com