
��һ�̶��ݻ����ܱ������н��������·�Ӧ��
CO2(g) + H2(g)  CO(g) + H2O(g)����ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�
CO(g) + H2O(g)����ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�
|
t�� |
700 |
800 |
850 |
1000 |
1200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K�ı���ʽΪ���� �� �������÷�Ӧ������ӦΪ���� ����Ӧ�������ȡ����ȡ���
(2) ���жϸ÷�Ӧ�Ƿ��Ѿ��ﵽ��ѧƽ��״̬���ǣ�
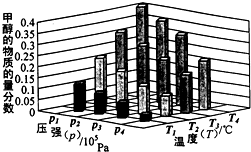
����������ѹǿ���䡡�� �£����������COŨ�Ȳ���
�ã�v(H2)��= v(H2O)�桡�� D��c(CO2) = c(CO)��
��3��ij�о�С�����÷�Ӧ��CO(g)+H2O(g)  H2(g)+CO2(g) ��H=��41.2kJ/mol���Ʊ�CO2��H2�Ļ�����塣�ü�Һ����һ����CO2�ķ�������������H2��CO2������ȡ�����1L1.5mol/L��NaOH��Һ���������22.4L��������Ϊ��״���������CO2�������պ���Һ�и�����Ũ�ȴӴ�С��˳���� ��
H2(g)+CO2(g) ��H=��41.2kJ/mol���Ʊ�CO2��H2�Ļ�����塣�ü�Һ����һ����CO2�ķ�������������H2��CO2������ȡ�����1L1.5mol/L��NaOH��Һ���������22.4L��������Ϊ��״���������CO2�������պ���Һ�и�����Ũ�ȴӴ�С��˳���� ��
��4���罫H2��CO2��4:1������Ȼ�ϣ����ʵ��������¿��Ƶ�CH4����֪��
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O��1�� ��H1����890.3 kJ/mol
CO2(g)+ 2H2O��1�� ��H1����890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O��1�� ��H2����285.8 kJ/mol
H2O��1�� ��H2����285.8 kJ/mol
��CO2(g)��H2(g)��Ӧ����CH4(g)��Һ̬ˮ���Ȼ�ѧ����ʽ�� ��
��5��������ȼ�ϵ������ͼ��

��ͼ��������̼����Ϊ����ʣ���CH4Ϊȼ�ϣ�����Ϊ��������ϡ����������Ϊ�缫����֪�����ĵ缫��Ӧ��CH4 +4CO32����8e��=5CO2+2H2O�������ĵ缫��Ӧ��_______ ��Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ���Ϊ�˵�ع���ʱ�����в���A���ʲμ�ѭ������A���ʵĻ�ѧʽ��_________��ʵ������У���ͨ���˱�״���¿���448L�����������O2�������Ϊ20%������������ȼ�ϵ�����ı�״����CH4____________L��
��1�� �� ���ȣ�
�� ���ȣ�
��2��B��C��
��3��c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
��4��CO2(g)+4H2(g)=CH4(g)+2H2O(l) ��H=��252.9kJ/mol
��5��O2+4e-+2CO2=2CO32- CO2 44.8
��������
�����������1����ӦCO2(g) + H2(g)  CO(g) + H2O(g) ƽ�ⳣ������ʽΪ
CO(g) + H2O(g) ƽ�ⳣ������ʽΪ ���ɱ��������ݿ�֪�������¶����ߣ�ƽ�ⳣ�����٣�˵������Ӧ�Ƿ��ȷ�Ӧ����2�������ݻ��̶�����Ӧǰ���������ʵ������䣬����������ƽ��״̬���Ƿ�ƽ��״̬��������ѹǿ�����䣬A����ѧƽ��״̬�ı�־�������淴Ӧ������ȣ������Ũ�ȱ��ֲ��䣬����COŨ�ȱ��ֲ����״̬��ƽ��״̬��B��ȷ��H2��H2O�ļ�������Ϊ1��1������v(H2)��=
v(H2O)����״̬��ƽ��״̬��C��ȷ��������̼��һ����̼Ũ����Ȳ�����Ϊ�жϷ�Ӧ��ƽ��״̬�ı�־��ƽ��ʱ����Ũ�ȿ������Ҳ���ܲ��ȣ��������̼��ʼͶ�ϺͶ�����̼��ת�����й�ϵ��D����3��CO2��NaOH��Ӧ�����������CO2+2NaOH=Na2CO3+H2O��NaOH+CO2=NaHCO3������CO2��NaOH���ʵ�����Ϊ2��3������1��1��1��2֮�䣬����1molCO2��1.5molNaOH����Na2CO3��NaHCO3����Na2CO3��NaHCO3���ʵ����ֱ�Ϊx��y����C�غ��x+y=1����Na�غ��2x+y=1.5�����x=y=0.5mol��CO32-ˮ������HCO3-��OH-��������Һ������Ũ���ɴ�С��˳��Ϊc(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)����4��CO2(g)+4H2(g)=CH4(g)+2H2O(l)
��H=4��H2����H1����252.9 kJ/mol����5������н���Ϊ����̼���Σ�����ͨ�����������������ӦΪO2+4e-=2O2-��O2-+CO2=CO32-������ʽ��Ӽ���O2+4e-+2CO2=2CO32-���ɵ缫��Ӧ��֪ͼ�е�AΪCO2����������������ת����ȵ�CH4��8e-��2O2������ͨ���O2Ϊ4molʱ��Ӧ��CH4Ϊ2mol��
���ɱ��������ݿ�֪�������¶����ߣ�ƽ�ⳣ�����٣�˵������Ӧ�Ƿ��ȷ�Ӧ����2�������ݻ��̶�����Ӧǰ���������ʵ������䣬����������ƽ��״̬���Ƿ�ƽ��״̬��������ѹǿ�����䣬A����ѧƽ��״̬�ı�־�������淴Ӧ������ȣ������Ũ�ȱ��ֲ��䣬����COŨ�ȱ��ֲ����״̬��ƽ��״̬��B��ȷ��H2��H2O�ļ�������Ϊ1��1������v(H2)��=
v(H2O)����״̬��ƽ��״̬��C��ȷ��������̼��һ����̼Ũ����Ȳ�����Ϊ�жϷ�Ӧ��ƽ��״̬�ı�־��ƽ��ʱ����Ũ�ȿ������Ҳ���ܲ��ȣ��������̼��ʼͶ�ϺͶ�����̼��ת�����й�ϵ��D����3��CO2��NaOH��Ӧ�����������CO2+2NaOH=Na2CO3+H2O��NaOH+CO2=NaHCO3������CO2��NaOH���ʵ�����Ϊ2��3������1��1��1��2֮�䣬����1molCO2��1.5molNaOH����Na2CO3��NaHCO3����Na2CO3��NaHCO3���ʵ����ֱ�Ϊx��y����C�غ��x+y=1����Na�غ��2x+y=1.5�����x=y=0.5mol��CO32-ˮ������HCO3-��OH-��������Һ������Ũ���ɴ�С��˳��Ϊc(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)����4��CO2(g)+4H2(g)=CH4(g)+2H2O(l)
��H=4��H2����H1����252.9 kJ/mol����5������н���Ϊ����̼���Σ�����ͨ�����������������ӦΪO2+4e-=2O2-��O2-+CO2=CO32-������ʽ��Ӽ���O2+4e-+2CO2=2CO32-���ɵ缫��Ӧ��֪ͼ�е�AΪCO2����������������ת����ȵ�CH4��8e-��2O2������ͨ���O2Ϊ4molʱ��Ӧ��CH4Ϊ2mol��
���㣺��ѧƽ�ⳣ�� ��ѧƽ��״̬�ı�־ ����Ũ�ȱȽ� ��˹���� �绯ѧ
���������⣨5��Ҳ����д��ȼ�ϵ���ܷ�ӦCH4+2O2=CO2+2H2O�����ܷ�Ӧ��ȥ�����缫��Ӧʽ���������缫��Ӧʽ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮
���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮| 1 |
| 2 |
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3������/��10-6mol�� | 4.8 | 5.9 | 6.0 |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| ���� |
| ���¸�ѹ |
| ���� ��� |
��ʼʱ�����ʵ����ʵ���/mol | ��Ӧ��ƽ��ʱ���ʱ�/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | ��H1=-23.1 |
| B | 0.9 | 2.7 | 0.2 | ��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��Դ����Լ���ҷ�չ���̵�����֮һ���״��������ѵȱ���Ϊ2 1���͵���ɫ��Դ����ҵ��������Ȼ��Ϊ��Ҫԭ���������̼��ˮ������һ���������Ʊ��ϳ�����CO��H2�������Ƴɼ״��������ѣ�
��Դ����Լ���ҷ�չ���̵�����֮һ���״��������ѵȱ���Ϊ2 1���͵���ɫ��Դ����ҵ��������Ȼ��Ϊ��Ҫԭ���������̼��ˮ������һ���������Ʊ��ϳ�����CO��H2�������Ƴɼ״��������ѣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011���㽭ʡ���ݸ���ѧ�����߿�ȫ��ģ��������ۣ���ѧ���� ���ͣ������
���Ǵ����к����ḻ��һ��Ԫ�أ������仯������������������������Ҫ���ã����ٵ���������ŷ��ǻ�����������Ҫ����֮һ����ش����е����仯�����������⣺
��1���ݱ������������ѧ�һ���˼����о���ֵ��N4������ӽṹ������ӵ���������ṹ���ơ���֪����1 mol N��N������167 kJ����������1 mol N��N���ų�942 kJ��������д��N4����ת��ΪN2��Ӧ���Ȼ�ѧ����ʽ��______________________��
��2���ݱ�����NH3��ֱ����������ȼ�ϵ�أ�д���õ�صĸ�����Ӧʽ��
__________________________________________________________________________��
��3����T1��ʱ����5 mol N2O5����10 L�̶��ݻ����ܱ������з������з�Ӧ��2N2O5(g) 4NO2(g)+O2(g)����H��0����Ӧ��5����ʱ�����ʵ�Ũ�Ȳ��ٷ����仯�����NO2���������Ϊ50%��
4NO2(g)+O2(g)����H��0����Ӧ��5����ʱ�����ʵ�Ũ�Ȳ��ٷ����仯�����NO2���������Ϊ50%��
������ƽ����ϵ��O2���������Ϊ__________��N2O5�����ʵ���Ϊ__________mol��
����O2��ʾ��0��5 min�ڸ÷�Ӧ��ƽ�����ʦ�(O2)= __________��
�۽�����ƽ����ϵ���¶Ƚ���T2�棬�ܱ������ڼ�С����������__________��
A��ѹǿ B���ܶ� C����Ӧ���� D��N2O5��Ũ��
��4���ں��º��ݵ��ܱ������г���NO2����������ƽ�⣺2NO2(g) N2O4(g)��ƽ��ʱN2O4��NO2�����ʵ���֮��Ϊa�������������������£��ֱ��ٳ���NO2���ٳ���N2O4��ƽ�������ı仯��ȷ����__________��
N2O4(g)��ƽ��ʱN2O4��NO2�����ʵ���֮��Ϊa�������������������£��ֱ��ٳ���NO2���ٳ���N2O4��ƽ�������ı仯��ȷ����__________��
A��������a��С B��������a����
C������NO2����a��������N2O4����a����
D������NO2����a������N2O4����a��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014���㽭ʡ������ʮУ�����������ѧ������������ѧ�Ծ��������棩 ���ͣ������
���Ǵ����к����ḻ��һ��Ԫ�أ������仯������������������������Ҫ���ã����ٵ���������ŷ��ǻ�����������Ҫ����֮һ����ش����е����仯�����������⣺
(1)�ݱ������������ѧ�һ���˼����о���ֵ��N4������ӽṹ������ӵ���������ṹ���ơ���֪����1 mol N��N������167 kJ����������1 mol N��N���ų�942 kJ��������д��N4����ת��ΪN2��Ӧ���Ȼ�ѧ����ʽ�� ��
(2)�ݱ�����NH3��ֱ����������ȼ�ϵ�أ�д���õ�صĸ�����Ӧʽ�� ��
(3)��T1��ʱ����5 mol N2O5����10L�̶��ݻ����ܱ������з������з�Ӧ��2N2O5(g) 4NO2(g)+O2(g)����H��0����Ӧ��5����ʱ�����ʵ�Ũ�Ȳ��ٷ����仯�����NO2���������Ϊ50%��
4NO2(g)+O2(g)����H��0����Ӧ��5����ʱ�����ʵ�Ũ�Ȳ��ٷ����仯�����NO2���������Ϊ50%��
����÷�Ӧ��ƽ�ⳣ��K= (���ִ���ʽ�Ӽ���)������ƽ����ϵ��O2���������Ϊ__________��
����O2��ʾ��0��5 min�ڸ÷�Ӧ��ƽ�����ʦ�(O2)= ��
�۽�����ƽ����ϵ���¶Ƚ���T2�棬�ܱ������ڼ�С���������� ��
A��ѹǿ B���ܶ� C����Ӧ���� D��N2O5��Ũ��
(4)�ں��º��ݵ��ܱ������г���NO2����������ƽ�⣺2NO2(g) N2O4(g)��ƽ��ʱN2O4��NO2�����ʵ���֮��Ϊa�������������������£��ֱ��ٳ���NO2���ٳ���N2O4��ƽ�������ı仯��ȷ����__________��
N2O4(g)��ƽ��ʱN2O4��NO2�����ʵ���֮��Ϊa�������������������£��ֱ��ٳ���NO2���ٳ���N2O4��ƽ�������ı仯��ȷ����__________��
A��������a��С B��������a���� C������NO2����a��С������N2O4����a����
D������NO2����a������N2O4����a��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�������½�2mol SO2��2mol SO3��������һ�̶��ݻ����ܱ������У�������Ӧ��
2SO2��O2 ![]() 2SO3��ƽ��ʱSO3Ϊn mol������ͬ�¶��£��ֱ����������������
2SO3��ƽ��ʱSO3Ϊn mol������ͬ�¶��£��ֱ����������������
���з�����ʼ���ʣ�ƽ��ʱSO3�����ʵ������ܴ���n���� �� ��
A��2 mol SO2 �� 1 mol O2 B��4 mol SO2 �� 1 mol O2
C��2 mol SO2 �� 1 mol O2 �� 2 SO3 D��3 mol SO2 �� 1 SO3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com