
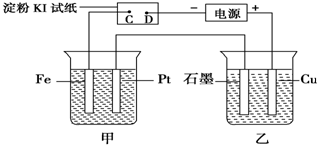
分析 (1)D点与负极相连为阴极,C点为阳极,阳极上碘离子失电子生成单质碘;
(2)装置甲中Pt与正极相连为阳极;Fe为阴极,阴极上银离子得电子生成Ag;
(3)乙装置中Cu与正极相连失电子生成铜离子,石墨上氢离子得电子生成氢气和氢氧根离子;
(4)甲、乙装置中共收集到标准状况下的气体0.168L,应分别为氧气和氢气,则氧气为0.168L×$\frac{1}{3}$=0.056L,n(02)=$\frac{0.056L}{22.4L/mol}$=0.0025mol,转移电子0.01mol,结合电子守恒计算;乙中析出硫酸钠晶体(Na2SO4﹒10H2O)ωg,由于阳极生成铜离子,溶液中应生成氢氧化铜沉淀,可认为硫酸钠全部析出,则m(Na2SO4)=$\frac{142w}{322}$g,
根据2H2O-2e-=2H++2OH-可知消耗水为0.01mol,质量为0.18g,则溶液质量为(w+0.18)g,再求出电解前饱和Na2SO4溶液中溶质的质量分数.
解答 解:(1)D点与负极相连为阴极,C点为阳极,阳极上碘离子失电子生成单质碘,单质碘遇到淀粉溶液会变蓝色,所以C点变蓝色;
故答案为:C;
(2)装置甲中Pt与正极相连为阳极;Fe为阴极,阴极上银离子得电子生成Ag,则阴极的电极方程式为:Ag++e-=Ag;
故答案为:Pt;Ag++e-=Ag;
(3)乙装置中Cu与正极相连失电子生成铜离子,所以Cu电极附近溶液变蓝色,石墨上氢离子得电子生成氢气和氢氧根离子,氢氧根离子与铜离子结合生成氢氧化铜蓝色沉淀;
故答案为:①Cu极附近溶液变蓝 ②石墨电极逸出气体 ③溶液中出现蓝色沉淀;
(4)甲、乙装置中共收集到标准状况下的气体0.168L,应分别为氧气和氢气,则氧气为0.168L×$\frac{1}{3}$=0.056L,n(02)=$\frac{0.056L}{22.4L/mol}$=0.0025mol,转移电子0.01mol,
甲中盛有AgNO3溶液,电解时生成硝酸,n(H+)=n(e-)=0.01mol,则c(H+)=$\frac{0.01mol}{1L}$=0.01mol/L,则pH=2;
乙中析出硫酸钠晶体(Na2SO4﹒10H2O)ωg,由于阳极生成铜离子,溶液中应生成氢氧化铜沉淀,可认为硫酸钠全部析出,则m(Na2SO4)=$\frac{142w}{322}$g,
根据2H2O-2e-=2H++2OH-可知消耗水为0.01mol,质量为0.18g,则溶液质量为(w+0.18)g,
所以质量分数为$\frac{142w}{322(w+0.18)}$×100%=$\frac{71w}{161(w+0.18)}$×100%;
故答案为:2;$\frac{71w}{161(w+0.18)}$×100%.
点评 本题综合考查电解原理,侧重于考查学生综合运用电解知识的能力,题目难度较大,注意把握电解规律以及电子守恒在计算中的应用,能正确判断电极方程式.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | A | B | C |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物的水溶液显碱性 | 原子有三个电子层,简单离子在本周期中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硫酸铜溶液除去铁粉中混有的铜粉 | |
| B. | 用碳酸钙除去氯化钙溶液中混有的稀盐酸 | |
| C. | 用稀硫酸除去氯化钠中混有的碳酸钠 | |
| D. | 用点燃方法除去二氧化碳中混有的一氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)=2H2O(l)△H=-483.6 kJ•mol-1,则氢气的燃烧热为483.6 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1<△H2 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Zn的质量/g | Zn的形状 | 温度/℃ | 溶于酸的时间/s | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 45 | 25 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 薄片 | 15 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液与碘化钾溶液反应:Fe3++2I-═Fe2++I2 | |
| B. | 硫酸溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 氯化镁溶液与过量氨水反应:Mg2++2NH3•H2O═Mg (OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com