
【题目】将 10mL0.2 mol·L-1 氯化铵溶液跟 25 mL0.05 mol·L-1 氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序为
A. c(Cl-) >c(OH-) > c(NH4+)>c( Ba2+)
B. c(Cl-) >c(Ba2+) >c(OH-)>c(NH4+)
C. c(Ba2+) >c(Cl-) >c(OH-) >c(NH4+)
D. c(Cl-) >c(Ba2+)>c (NH4+) >c(OH-)
【答案】B
【解析】
先计算氯化铵和氢氧化钡的物质的量,再利用氯化铵和氢氧化钡的反应来分析反应后所得溶液中各种离子的物质的量的多少。
10mL0.2 mol·L-1 氯化铵溶液中硝酸铵的物质的量为10mL×10-3L×0.2mol/L=0.002mol,
25 mL0.05 mol·L-1氢氧化钡溶液中氢氧化钡的物质的量为25mL×10-3L×0.05mol/L=0.00125mol,
氯化铵和氢氧化钡混合以后发生反应:2NH4Cl+Ba(OH)2=BaCl2+2NH3![]() H2O,
H2O,
则反应后,35mL溶液的组成为:剩余氢氧化钡0.00025,生成的氯化钡0.001mol,生成的一水合氨0.002mol,
在体积一样的前提下,物质的量越大,浓度越大,故c(Cl-) >c(Ba2+),
而氨水能电离出少量且相等的铵根和氢氧根,氢氧化钡中还有0.0005mol的氢氧根,所以c(OH-) >c(NH4+),
故离子浓度大小顺序为:c(Cl-) >c(Ba2+) >c(OH-)>c(NH4+)。
所以B选项是正确的。


科目:高中化学 来源: 题型:
【题目】若下图表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。
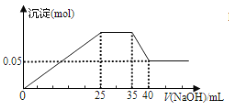
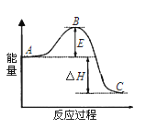
① ②
下列各表述与示意图一致的是( )
A. 图①三种离子的物质的量之比为:n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B. 图②中曲线表示某反应过程的能量变化, 若使用催化剂,B点会降低
C. 图①中使用的NaOH的浓度为2 mol/L
D. 图②中物质A反应生成物质C,ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色。
I、打磨过的细铁丝可在纯氧中剧烈燃烧,最终生成黑色固体;铁粉与水蒸气在高温下也可生成该黑色固体,
(1)反应的化学方程式为 __________________________。
(2)将该黑色固体溶于盐酸中,反应的离子反应方程式 _________________。
II、某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
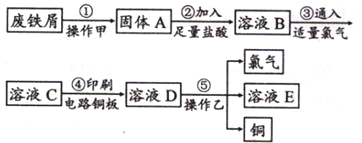
请回答下列问题:
(1)步骤②中,除发生反应Fe +2HCl=FeCl 2 +H 2 ↑外,其他可能反应的离子方程式为____________。
(2)若将③该加H2O2 书写离子反应方程式__________。
(3)若溶液B中只含有Fe 2+ 而不含Fe 3+ ,可证明该事实的实验方法是(_____)
①先加氯水,后加KSCN溶液后显红色;
②先加KSCN溶液,不显红色,再加氯水后显红色;
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色;
④只滴加KSCN溶液不显红色。
A.①② B、②③ C、③④ D、①④
(4)步骤④化学方程式为 ______________________。
(5)若除去氯化铜中氯化铁可以加入剂 ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2H2+O2![]() 2H2O放出能量,下列说法中正确的是( )
2H2O放出能量,下列说法中正确的是( )
A. 生成物水所具有的总能量高于反应物氢气和氧气所具有的总能量
B. 反应物氢气和氧气所具有的总能量高于生成物水所具有的总能量
C. 反应物氢气和氧气所具有的总能量等于生成物水所具有的总能量
D. 反应物氢气和氧气具有的能量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表的一部分,标出了A—K共十种元素所在位置。请用元素符号或化学式回答下列问题.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | A | B | ||||||
3 | C | D | E | F | G | |||
4 | H | I | K |
(1)10种元素中,化学性质最不活泼的是______,最活泼的金属是_____。
(2)C、E、F三种元素形成的简单离子半径最小的是_______。
(3)C、K形成的化合物中化学键的类型属于________
(4)化合物C2B2的电子式为__________________;该化合物和AB2反应的化学方程式为__________________________________________。
(5)E的最高价氧化物属于________________性氧化物,它与氢氧化钠溶液反应的离子方程式为____________________________________________。
(6)D的单质在A、B形成化合物中燃烧的化学方程式为________________________。
(7)用电子式表示H与B组成的H2B型化合物的形成过程:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,它们原子的核电荷数均小于18,且依次递增。A原子核内仅有1个质子,B原子的电子总数与D原子的最外层电子数相等,A原子与B原子的最外层电子数之和与C原子的最外层电子数相等,D原子的最外层电子数是次外层电子数的3倍。
(1)请写出这四种元素元素名称:A_____;B_____;C_____;D_____。
(2)A与C形成常见化合物的化学式是_____,该化合物的水溶液呈_____性。
(3)B与D形成的化合物能溶于水,且与水反应的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,下列说法不正确的是( )

A. 装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
B. 甲、乙装置中的能量变化均为化学能转化为电能
C. 装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
D. 装置乙中负极的电极反应式:Zn-2e-===Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取溴的工业流程如图:

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是______.
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的______.(填序号)
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数及相应物质:_______
□Br2+□CO32-═□BrO3-+□Br-+□______
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴与二氧化硫水溶液反应的化学方程式:______.
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是______.(填序号)
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com