
下列说法正确的是
A.将NaH溶于水,得到的水溶液能导电说明NaH是离子化合物
B.Fe(OH)3胶体和Fe(OH)3沉淀的化学性质不相同
C.乙醇分子中含羟基,可与金属钠反应生成氢气
D.MnO2具有较强氧化性,可作为H2O2分解反应的氧化剂
科目:高中化学 来源: 题型:
在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上。滤纸条的中部滴有KMnO4液滴;电源有a、b两极。在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电。
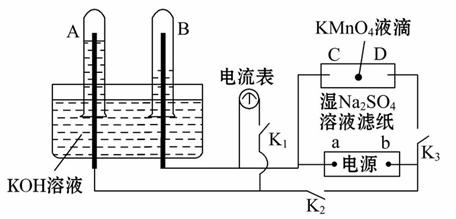
(1)写出B中电极反应式____________________________________________ ___。
___。
(2)在湿的硫酸钠溶液滤纸条中部的高锰酸钾液滴处发生的现象是__________。
(3)电解一段时间后,A、B中均有气体包围电极,此时切断K2、K3,闭合K1,则电流表的指针__________(填“是”或“否”)移动,其理由是_____________。
(4)在298 K时,若2 g B气体和0.5 mol的A气体完全反应,生成物为液态,放出285.8 kJ热量,写出此反应的热化学方程式:______________________
__________ ________________________________________________________。
________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列反应:Co2O3 + 6HCl(浓) == 2CoCl2 + Cl2↑+ 3H2O (I)

(1)反应(I)中的氧化剂是
(2)根据反应(I)计算,若生成标准状况下33.6L氯气时,电子转移数目是
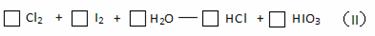 (3)将反应(II)配平
(3)将反应(II)配平
(4)反应(II) 中 发生氧化反应(5)HCl 、I2 、CoCl2三种物质的还原性由强到弱的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:
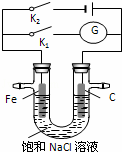
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
|
| A. | K1闭合,铁棒上发生的反应为2H++2e﹣→H2↑ |
|
| B. | K1闭合,石墨棒周围溶液pH逐渐升高 |
|
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
|
| D. | K2闭合,电路中通过0.4NA个电子时,两极共产生标况下4.48L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等.水垢会形成安全隐患,需及时清洗除去.清洗流程如下:
Ⅰ.加入NaOH 和 Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉.
(资料在线:K3[Fe(CN)6]溶液遇亚铁盐会生成蓝色沉淀.)
(1)用NaOH溶解二氧化硅的化学方程式是 .
(2)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有 .
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因 .
(3)步骤Ⅲ中,加入Na2SO3的目的是 .
(4)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜.
①完成并配平其反应的离子方程式:
Fe+ NO2+ H2O═ N2↑+ +
②钝化效果的检测一般可用滤纸浸渍配好的检测液后贴附于待测样品表面或直接将溶液涂、滴于待测表面.下面检测钝化效果的方法合理的是 .
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
d.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间.
查看答案和解析>>
科目:高中化学 来源: 题型:
酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2=NO+SO3,②2NO+O2=2NO2,③SO3+H2O=H2SO4,以下叙述错误的是
A.NO2由反应N2+2O2 2NO2生成
2NO2生成
B.总反应可表示为2SO2+O2+2H2O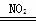 2H2SO4
2H2SO4
C.还可能发生的反应有4NO2+O2+2H2O=4HNO3
D.还可能发生的反应有4NO+3O2+2H2O=4HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验对应的结论不正确的是
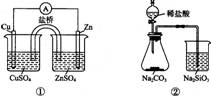
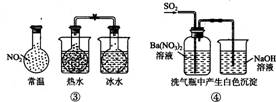
A.①能组成Zn-Cu原电池 B.②能证明非金属性Cl>C>Si
C.③能说明2NO2 N2O4 △H<0 D.④中自色沉淀为BaSO4
N2O4 △H<0 D.④中自色沉淀为BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于吸热反应和放热反应的说法正确的是 ( )
A.需加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件一定能发生
C.反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应
D.当ΔH<0时表明反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素,A 与D同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C元素的离子不含电子,D元素原子的最外层电子数是其次外层电子数的3/4,E元素原子的最外层电子数是其次外层电子数的3倍。
(1)A的原子结构示意图为 。
(2)0.1 mol/L A的硫酸盐溶液与0.1 mol/L NaOH溶液等体积混合,反应的离子
方程式为 。
(3)以A的单质和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池总反应的化学方程式是 。
(4)化合物甲由元素A、B组成,具有良好电绝缘性。
化合物甲能与水缓慢反应生成含B的化合物乙,乙分子中含有10个电子。写出该反应的化学方程式: 。
工业用A的单质和化合物乙在高于1700K反应制备甲。已知该反应可以认为是置换反应,该反应的化学方程式是 。
(5)D和E两种元素相比较,非金属性较强的是(填元素名称) ,可以验证该结论的是(填写编号) ;
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(6)C、D、E间可形成丙、丁两种分子,它们均含有18个电子,则丙与丁反应生成D单质的化学方程式为 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com