
【题目】食用香精D(丁二酸二乙酯)以及有机合成中间体E(1,4-二溴丁烷)的合成途径如下:
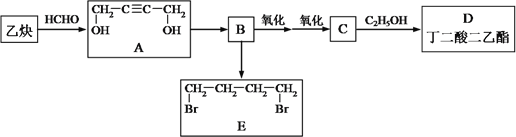
完成下列填空:
(1)A→B的反应类型是____________。B→E的化学方程式为_________________________。
(2)C的结构简式为______________________________。实验室由C生成D的反应条件是____________________。
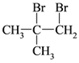
(3)写出两种有支链的E的同分异构体___________________。
(4)设计一条由乙炔制备乙酸的合成路线。(合成路线常用的表示方式为:A B ![]() 目标产物)_______________________
目标产物)_______________________
【答案】 加成反应(或还原反应) ![]() +2HBr
+2HBr![]()
![]() +2H2O或:
+2H2O或:![]() +2NaBr+2H2SO4
+2NaBr+2H2SO4![]()
![]() +2NaHSO4+2H2O HOOCCH2CH2COOH 浓硫酸、加热
+2NaHSO4+2H2O HOOCCH2CH2COOH 浓硫酸、加热 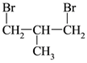 、
、 、
、![]() CH≡CH
CH≡CH![]() CH2=CH2
CH2=CH2 C2H5OH
C2H5OH![]() CH3CHO
CH3CHO![]() CH3COOH或:CH≡CH
CH3COOH或:CH≡CH![]() CH3CHO
CH3CHO![]() CH3COOH
CH3COOH
【解析】1分子乙炔与2分子甲醛发生加成反应生成A(![]() ),
),![]() 与氢气发生加成反应生成B为
与氢气发生加成反应生成B为![]() ,
,![]() 与浓的氢溴酸发生取代反应生成E(
与浓的氢溴酸发生取代反应生成E(![]() )和水,
)和水,![]() 经过两步氧化生成1,4-丁二酸,1,4-丁二酸与乙醇发生酯化反应生成D(丁二酸二乙酯)。(1)A→B是
经过两步氧化生成1,4-丁二酸,1,4-丁二酸与乙醇发生酯化反应生成D(丁二酸二乙酯)。(1)A→B是![]() 与氢气发生加成反应生成
与氢气发生加成反应生成![]() ,反应类型是加成反应;B→E是
,反应类型是加成反应;B→E是![]() 与浓的氢溴酸发生取代反应生成
与浓的氢溴酸发生取代反应生成![]() 和水,反应的化学方程式为
和水,反应的化学方程式为![]() +2HBr
+2HBr![]()
![]() +2H2O或:
+2H2O或:![]() +2NaBr+2H2SO4
+2NaBr+2H2SO4![]()
![]() +2NaHSO4+2H2O;(2)C的结构简式为HOOCCH2CH2COOH;实验室由C生成D是1,4-丁二酸与乙醇发生酯化反应生成丁二酸二乙酯和水,反应条件是浓硫酸、加热;(3)有支链的E(
+2NaHSO4+2H2O;(2)C的结构简式为HOOCCH2CH2COOH;实验室由C生成D是1,4-丁二酸与乙醇发生酯化反应生成丁二酸二乙酯和水,反应条件是浓硫酸、加热;(3)有支链的E(![]() )的同分异构体可以为
)的同分异构体可以为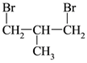 、
、 、
、![]() ;(4)乙炔与氢气部分加成生成乙烯,乙烯水化催化得到乙醇,乙醇氧化得到乙醛,乙醛氧化得到乙酸;或乙炔水化催化得到乙醛,乙醛氧化得到乙酸,合成路线为:CH≡CH
;(4)乙炔与氢气部分加成生成乙烯,乙烯水化催化得到乙醇,乙醇氧化得到乙醛,乙醛氧化得到乙酸;或乙炔水化催化得到乙醛,乙醛氧化得到乙酸,合成路线为:CH≡CH![]() CH2=CH2
CH2=CH2 C2H5OH
C2H5OH![]() CH3CHO
CH3CHO![]() CH3COOH或:CH≡CH
CH3COOH或:CH≡CH![]() CH3CHO
CH3CHO![]() CH3COOH。
CH3COOH。


科目:高中化学 来源: 题型:
【题目】下列对非金属元素(除稀有气体元素外)的相关判断正确的是( )
①最外层电子数≥4的元素均为非金属元素
②单质在反应中都只能作氧化剂
③非金属元素都是主族元素
④氧化物常温下都可以与水反应生成酸
⑤ⅦA族元素是同周期中非金属性最强的元素
A.②⑤B.③⑤C.②③④D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成细胞的化学元素说法正确的是
A. 植物细胞中含量最多的四种元素是C、H、O、N
B. 微量元素因含量极少而不如大量元素重要
C. 细胞中某种必需元素可被其他元素替代
D. 组成DNA和RNA的元素种类不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3CH=CH2与HCl可发生反应①和②,其能量与反应进程如下图所示:
① CH3CH=CH2 + HCl → CH3CH2CH2Cl
② CH3CH=CH2 + HCl → CH3CHClCH3
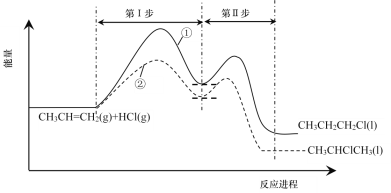
下列说法错误的是
A. 反应①、②均为加成反应
B. 反应①的Ⅰ、Ⅱ两步均放出能量
C. CH3CHClCH3比CH3CH2CH2Cl稳定
D. CH3CH2CH2Cl与CH3CHClCH3互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用标准0.1400molL﹣1NaOH溶液滴定未知浓度硫酸的实验操作如下 A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入酚酞.
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2﹣3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,用去NaOH溶液15.00mL.
(1)①滴定操作的正确顺序是(用序号填写);②在G操作中如何确定终点? .
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) .
(3)配制100mLNaOH标准溶液,必须使用到的玻璃仪器是
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值(选填“偏大”“偏小”或“无影响”)
(5)计算待测硫酸溶液的物质的量浓度 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水.已知室温下1g甲硅烷自燃放出44.6kJ, 其热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸参与热化学循环可通过二步循环或三步循环制取氢气,其中三步循环(碘硫热化学循环)原理如下图所示:

(1)“步骤Ⅰ.硫酸热分解”在恒容密闭容器中进行,测得各物质的物质的量分数与温度的关系如下图所示。其在650~1200℃间发生的主要反应的方程式为____。
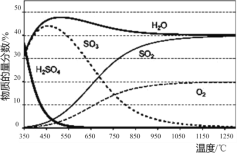
(2)“步骤Ⅱ.硫酸再生”的离子方程式为____(HI是强酸)。
(3)步骤Ⅲ的反应为2HI(g) ![]() H2(g) + I2(g) 。
H2(g) + I2(g) 。
①若在恒温恒容密闭容器中进行该反应,能说明已达到平衡状态的是___(填序号)。
a.容器内气体的总压强不再随时间而变化
b.n(HI)∶n(H2)∶n(I2)=2∶1∶1
c.反应速率:v(H2)正=v(H2)逆
d.I2(g)浓度不再随时间的变化而变化
②已知断裂(或生成)1mol化学键吸收(或放出)的能量称为键能。相关键能数据如下:
化学键 | H—I | H—H | I—I |
键能/kJ·mol-1 | 298.7 | 436.0 | 152.7 |
则该反应的![]() H为____kJ·mol-1。
H为____kJ·mol-1。
(4)将“三步循环”中步骤Ⅱ、Ⅲ用下图装置代替即为“二步循环”。
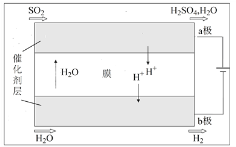
下列有关该装置的相关说法正确的是____(填序号)。
a.化学能转变为电能
b.催化剂可加快电极上电子的转移
c.反应的总方程式为SO2+2H2O ![]() H2+H2SO4
H2+H2SO4
d.每生成1molH2,电路中流过的电子数约为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com