(1)金属钛(
22Ti)将是继铜、铁、铝之后人类广泛使用的第四种金属,请你写出钛的基态原子的电子排布式
1S22S22P63S23P63d24S2
1S22S22P63S23P63d24S2
.
(2)二氧化钛作光催化剂能将居室污染物甲醛、苯、二甲苯等有害物质可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二甲苯、二氧化碳及水说法正确的是
BC
BC
.
A.苯与B
3N
3H
6互为等电子体,分子中原子共平面,且都有三种二氯代物;
B.二氧化碳、甲醛、氯仿(CHCl
3)中碳原子分别采用sp、sp
2、sp
3杂化;
C.对二甲苯是非极性分子,邻二甲苯和间二甲苯都是极性分子;
D.氨比甲醛易溶于水,是因为甲醛与水分子间不能形成氢键.
(3)日常生活中广泛使用的不锈钢就是含铬合金,铬元素原子中末成对电子数为
6
6
.
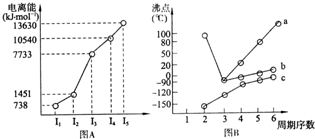
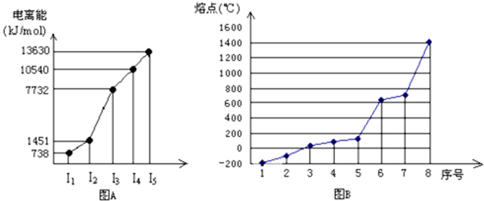
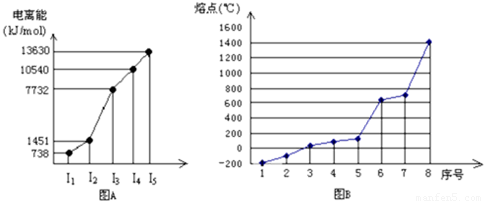
(4)①短周期某主族元素M的逐级电离能情况如下图A所示,则M元素形成化合物时,表现的主要化合价为
+2
+2
价.
②第三周期八种元素按单质熔点高低的顺序如下图B所示,其中序号“8”代表
Si
Si
(填元素符号),其中电负性最大的是
2
2
(填图B中的序号)

(5)氢气作为一种清洁能源,必须解决它的储存问题,C
60可用作储氢材料.科学家把C
60和K掺杂在一起制造了一种富勒烯

化合
物,其晶胞如图所示,该物质在低温时是一种超导体.该物质的K原子和C
60分子的个数比为
3:1
3:1
.
(6)在配合物Fe(SCN)
2+离子中,提供空轨道接受孤对电子的微粒是
Fe3+
Fe3+
.


 化合
化合

 全能测控期末小状元系列答案
全能测控期末小状元系列答案