
【题目】V升pH均为2的盐酸和醋酸溶液分别用NaOH溶液中和,消耗NaOH的量
A. 前者多 B. 后者多 C. 一样多 D. 无法确定
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列反应过程能量变化如下所示:
H2(g)+Cl2(g)=2HCl(g)ΔH

下列说法错误的是
A.H—H键比Cl—Cl键稳定
B.正反应活化能比逆反应活化能高
C.ΔH= — 184.5 kJ·mol-1
D.在相同条件下,1mol H2(g)和1mol Cl2(g)分别在点燃和光照条件下反应生成2mol HCl(g),重新恢复到原来的状态时ΔH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是人类获取能量的重要途径。
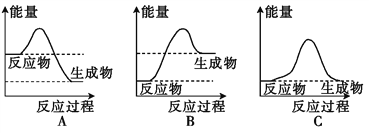
(1)液化气是一种重要的家用燃料,下列示意图与液化气在燃烧过程中的能量 变化最相符的是___________(填字母)。
(2)“冰袋”可用于短时间保鲜食物。将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手将袋内两种固体粉末充分混合,便立即产生低温。由此判断:反应后生成产物的总能量_______(填“高于”或“低于”)碳酸钠晶体与硝酸铵晶体的总能量。
(3)化学反应中的能量变化不仅仅表现为热量的变化,有时还可以表现为其他形式的能量变化。比如,蜡烛燃烧可用来照明,这个过程是将化学能转化为光能和________;人们普遍使用的干电池工作时是将化学能转化为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图得出的结论正确的是( )
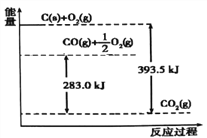
A. 1mol C完全燃烧生成CO2时放出的热量为393.5 kJ/mol
B. 2C(s)+O2(g)=2CO(g) △H=-221.0 kJ/mol
C. 2CO2 (g)=2CO(g)+O2(g) △H=+283.0 kJ/mol
D. C(s)+O2(g)= CO2 (g) △H=+393.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:

(1)在圆底烧瓶中加入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精,加入酒精的作用是________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得的混合物为_____________(选填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入______________,静置一段时间后,溶液分为上下两层,肥皂在________层,这个操作称为____________。
(4)图中长玻璃导管的作用为__________________________。
(5)写出该反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)A的元素符号______________,D的元素名称 ____________。
(2)C在周期表中的位置为第______周期______族,E的离子结构示意图________;
(3)B、C、E分别与A形成的化合物中最稳定的是________(写化学式);E、F的最高价氧化物对应的水化物的酸性较强的是________(写化学式)
(4)F的单质在反应中常作氧化剂,该单质的水溶液与E的低价氧化物反应的离子方程式为________________。
(5)X在纯净的C单质中可以安静的燃烧,生成B的单质。该方应的化学方程式为:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程如下:

有关物质的溶度积常数
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
(1)已知,锂电池放电正极的电极反应为:LiMn2O4+e-+Li+= Li2Mn2O4,则锂电池正极材料锰酸锂中,锰元素的化合价为________。
(2)流程中,FeSO4的作用是_______,MnO的作用是_________,当滤液中的pH为6时,滤液中所含铝离子的浓度为___________。
(3)采用下图装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为________;电解产生的MnO2沉积在电极上,该电极反应式为_________。
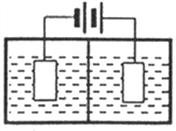
(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出。则Fe2+与矿浆中MnO2反应的离子方程式为__________。
(5)写出高温煅烧生成锰酸锂的化学方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com