
【题目】下列各组离子中,能大量共存的是
A.K+、Cl-、HCO3-、Al3+
B.H+、Fe2+、NO3-、Na+
C.NH4+、SO42-、K+、OH-
D.Na+、NH4+、Cl-、NO3-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列平衡体系中,升温或减压都能使平衡向正反应方向移动的是( )
A.N2(g)+3H2(g) ![]() 2NH3(g) ΔH <0
2NH3(g) ΔH <0
B.N2(g)+O2(g) ![]() 2NO(g) ΔH <0
2NO(g) ΔH <0
C.C(s)+2H2O(g) ![]() CO2(g)+2H2(g) ΔH >0
CO2(g)+2H2(g) ΔH >0
D.2SO2(g)+O2(g) ![]() 2SO3(g) ΔH <0
2SO3(g) ΔH <0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见右图,电池总反应可表示为:2H2 + O2 == 2H2O,下列有关说法不正确的是( )
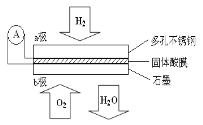
A.电子通过外电路从a极流向b极
B.b极上的电极反应式为:O2+4H++4e-==2H2O
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 烷基取代苯(![]() )可以被酸性KMnO4溶液氧化生成
)可以被酸性KMnO4溶液氧化生成![]() ,但若烷基R中直接与苯环连接的碳原子没有C—H键,则不容易被氧化得到
,但若烷基R中直接与苯环连接的碳原子没有C—H键,则不容易被氧化得到![]() 。
。
现有分子式是C11H16的烷基一取代苯,则它可以被氧化成为![]() 的同分异构体共有 种, 并写出一种不能被氧化成为
的同分异构体共有 种, 并写出一种不能被氧化成为![]() 的同分异构体的结构简式 。
的同分异构体的结构简式 。
(2)物质A、B、C的转化关系如图所示:
![]()
①若A 为常见金属,C为淡黄色固体,C与水反应生成D,则D的电子式为 。
②若A分子含有10个电子且有刺激性气味的气体,则A的结构式为 ,写出A生成B的反应方程式为: 。
③若A为黄绿色气体, X为常见金属单质,C溶液为浅绿色,则X元素在周期表中的位置 ;写出B与X反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学的化学兴趣小组对SO2与漂白粉的反应进行实验探究,实验过程如下:取10克漂白粉固体,加入250mL水中,部分固体溶解溶液略有颜色,过滤后用洁净的玻璃棒沾取滤液到pH试纸上,发现pH试纸先变蓝(约为12)后褪色.回答下列问题:
(1)工业制取漂白粉的化学方程式是 __ ,
漂白粉在空气中变质的原因 (用化学反应方程式说明)
(2)pH试纸颜色的变化说明漂白粉溶液具有的性质是 ,ClO2和漂白粉一样也具有强氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的 倍;
(3)将SO2持续通入漂白粉溶液中,发现澄清透明的溶液先变为黄绿色,随后溶液中产生大量白色沉淀且黄绿色褪去。回答下列问题:
①澄清透明溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂白粉的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 ;
②用离子方程式解释现象中黄绿色褪去的原因: ;
③SO2与漂白粉的有效成分在酸性条件下反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8 mL NO2和O2的混合气体通入倒立于水槽中装满水的量筒,充分反应后,剩余气体为1 mL,则原混合气体中NO2和O2的体积比可能为 ( )
A. 7∶5 B. 3∶7 C. 7∶1 D. 1∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表信息,下列叙述中正确的是

A.表中①反应的氧化产物只能有FeCl3
B.表中②生成1mol的O2将有4mol的电子转移
C.还原性比较:H2O2>Mn2+>Cl-
D.表中④的离子方程式配平后,H+的化学计量数为16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.氢氧化铁溶于氢碘酸溶液中:Fe(OH)3+3HI═Fe3++3I-+3H2O
B.少量CO2通入苯酚钠溶液中:![]()
C.向NaAlO2溶液中通入足量CO2:2AlO![]() +3H2O+CO2═2Al(OH)3↓+CO32-
+3H2O+CO2═2Al(OH)3↓+CO32-
D.Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO![]() +2OH-═CaCO3↓+CO32-+2H2O
+2OH-═CaCO3↓+CO32-+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com