
某科研小组以难溶性钾长石(K2O•Al2O3•6SiO2)为原料,提取A12O3、 K2CO3等物质,工艺流程如下:

(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的 化学方程式_____________________。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和 KAlO2,写出Al2O3转化为NaAlO2的化学方程式____________________________。
(2)已知NaAlO2和KAlO2易发生如下反应:AlO2-+2H2O Al(OH)3+OH-。
Al(OH)3+OH-。
“浸取”时,应保持溶液呈______性(填“酸”或“碱”)。“浸取”时不断搅拌的目的是______________。
(3)“转化”时加入NaOH的主要作用是_______ (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是_______、_______和水。
(16分)
(1)①CaCO3+SiO2 CaSiO3+CO2↑
(3分)
CaSiO3+CO2↑
(3分)
②Na2CO3+Al2O3 2NaAlO2+CO2↑
(3分)
2NaAlO2+CO2↑
(3分)
3 CuCl FeCl2(3分)
② Cl-+ CuCl = [CuCl2]-(2分)
③ 4FeCO3
+ O2 4CO2
+ 2Fe2O3 (3分)
4CO2
+ 2Fe2O3 (3分)
④ CuCl2、 NaCl (4分)
(2)(共4分)不会产生SO2污染大气(2分),不用煅烧黄铜矿从而节约热能 [或可得副产品铁红和硫,合理答案都行。2分]
【解析】
试题分析:(1)①读图可知,缺少的生成物为FeCl2、CuCl,硫元素由—2升为0,设CuFeS2的系数为1,则2个硫原子升高总数为4,铜元素由+2降为+1,1个铜原子降低数为1,由于升降总数相等,则铁元素由+3降为+2,需要3个铁原子降低总数3,则CuFeS2+3FeCl3=CuCl+4FeCl2+2S;②依题意,难溶的CuCl与可溶的NaCl在水中发生反应,其原理为Cl-+ CuCl =
[CuCl2]-;③依题意,该反应的反应物是FeCO3和O2,生成物是Fe2O3和CO2,铁元素由+2升为+3价,氧元素由0降为—2价,根据最小公倍数法配平可得:4FeCO3
+ O2 4CO2
+ 2Fe2O3;依题意,Na[CuCl2]在水中发生反应V,铜元素由+1部分升高为+2,部分降低为0,则溶液A中含有Cl-、Cu2+和Na+,所以推断A的溶质主要是CuCl2和NaCl;(2)传统方法需要高温煅烧,不仅消耗大量的能量,而且还产生大量的SO2等有毒气体,污染空气,新方法的优点是不会产生SO2污染大气,不用煅烧黄铜矿从而节约热能,可得副产品铁红和硫。
4CO2
+ 2Fe2O3;依题意,Na[CuCl2]在水中发生反应V,铜元素由+1部分升高为+2,部分降低为0,则溶液A中含有Cl-、Cu2+和Na+,所以推断A的溶质主要是CuCl2和NaCl;(2)传统方法需要高温煅烧,不仅消耗大量的能量,而且还产生大量的SO2等有毒气体,污染空气,新方法的优点是不会产生SO2污染大气,不用煅烧黄铜矿从而节约热能,可得副产品铁红和硫。
考点:考查有关物质制备的化学工艺流程推断题,涉及化学方程式的配平、主要流程中离子方程式、推断溶液的主要溶质、评价两种工艺的优缺点等。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
- 2 |
查看答案和解析>>
科目:高中化学 来源:2014届江苏省常州市高三第一次月考化学试卷(解析版) 题型:填空题
某科研小组以难溶性钾长石(K2O•Al2O3•6SiO2)为原料,提取A12O3、 K2CO3等物质,工艺流程如下:
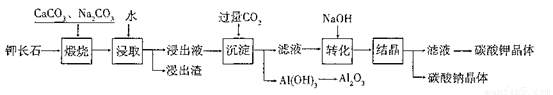
(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的 化学方程式_____________________。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和 KAlO2,写出Al2O3转化为NaAlO2的化学方程式____________________________。
(2)已知NaAlO2和KAlO2易发生如下反应:AlO2-+2H2O Al(OH)3+OH-。
Al(OH)3+OH-。
“浸取”时,应保持溶液呈______性(填“酸”或“碱”)。“浸取”时不断搅拌的目的是______________。
(3)“转化”时加入NaOH的主要作用是_______ (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是_______、_______和水。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市高三4月联考理综化学试卷(解析版) 题型:填空题
某科研小组以难溶性钾长石(K2O•Al2O3•6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:
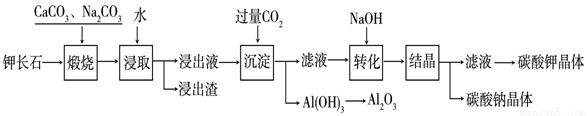
(1)煅烧过程中钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式是: 。
(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2—+ 2H2O 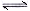 Al(OH)3
+ OH— ,“浸取”时应保持溶液呈
性(填“酸”或“碱”)。
Al(OH)3
+ OH— ,“浸取”时应保持溶液呈
性(填“酸”或“碱”)。
(3)“转化”时加入NaOH的主要作用是 (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是 、 和水。
(5)以Al2O3为原料,以石墨为电极,通过电解法可制得金属铝。电解池中接电源负极的一极的电极反应式是 。长时间电解后,需要更换新的石墨电极的是 极(填“阴”或“阳”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com