
| A. | 将该Na2CO3 溶液转移至250ml容量瓶中,加蒸馏水稀释至刻度线,摇匀 | |
| B. | 将该Na2CO3 溶液转移至250ml烧杯中,用量筒量取150ml蒸馏水加入,搅拌 | |
| C. | 将该Na2CO3 溶液转移至250ml烧杯中,用量筒量取400ml蒸馏水加入,搅拌 | |
| D. | 将该Na2CO3 溶液转移至500ml容量瓶中,加蒸馏水稀释至刻度线,摇匀 |
分析 A、容量瓶不能作为稀释仪器;
B、配制一定体积一定浓度的溶液要使用容量瓶;
C、配制一定体积一定浓度的溶液要使用容量瓶;
D、根据稀释前后溶质的物质的量不变计算配制后的溶液的体积,再根据配制步骤进行即可.
解答 解:A、容量瓶不能作为稀释仪器,是一种定容仪器,故A错误;
B、根据稀释前后,钠离子的物质的量保持不变,计算需要溶液的体积为:$\frac{100×0.5×2}{0.2}$mL=500mL,且溶液的配制应在容量瓶中进行,不能在烧杯中,故B错误;
C、配制一定体积一定浓度的溶液要使用容量瓶来定容,不能在烧杯中进行,且100mL的碳酸钠溶液加上400mL水之后所得溶液的体积不一定是500mL,故C错误;
D、根据稀释前后,钠离子的物质的量保持不变,计算需要溶液的体积为:$\frac{100×0.5×2}{0.2}$mL=500mL,要使用500mL的容量瓶,故D正确.
故选D.
点评 本题考查一定体积一定浓度的溶液的配制,注意容量瓶的使用原则以及配置的方法和有关的计算知识,难度不大.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH2OH | B. | (CH3)2COHCH2CH3 | ||
| C. | (CH3)2CHCH2CH2OH | D. | (CH3)3CCH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝能置换出氧化铁中的铁,钢铁工业利用铝热反应冶炼铁 | |
| B. | 用铝制容器盛放浓硝酸,是因为铝和浓硝酸不反应 | |
| C. | 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用 | |
| D. | 因为液态氨气化时吸热,可用液态氨作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉只有氢气产生的溶液中:Na+、SO42-、NO3-、Mg2+、 | |
| B. | 滴加石蕊试液显红色的溶液中:Fe3+、NH4+、Cl-、SCN- | |
| C. | 在0.1mol/L的NaHSO4溶液中:NH4+、Na+、Al3+、Cu2+、NO3- | |
| D. | 在0.1mol/L的NaHCO3溶液中K+、Al3+、Fe3+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
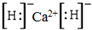 .
.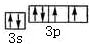 ;D与E能形成一种非极性分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.
;D与E能形成一种非极性分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(HA-)+2c(A2-)+c(OH-) | B. | c(H2A)+c(HA-)+c(A2-)=0.2mol•L-1 | ||
| C. | c(H+)•c(OH-)=10-14 | D. | c(A2-)+c(OH-)=c(H+)+c(H2A) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com