
用菱锰矿(MnCO3)常含有Fe2O3、FeO、HgCO3·2HgO等杂质,工业常用菱锰矿制取锰,工艺流程如下:
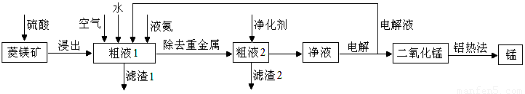
请回答下列问题:
(1)向粗液1中加入的水最后需要?????????? 方法才能达到技术要求。
(2)流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是??????????? 。
(3)净化剂主要成分为(NH4)2S,粗液2中发生主要反应的离子方程式为???????? 。
(4)写出阳极的电极反应式?????????? 。说明电解液循环的原因?????????????? 。
(5)写出铝热法炼锰的化学方程式????????????????????????????? 。
(1)蒸馏 (2)空气中的氧气和氮气透过分离膜的能力不同??
(3)Hg2++S2?= HgS↓?
(4)Mn2++2H2O-2e?=MnO2+4H+;回收未反应的Mn2+,提高二氧化锰的产率。
(5)3MnO2+4Al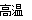 2Al2O3+3Mn (2分 )
2Al2O3+3Mn (2分 )
【解析】
试题分析:分析题给信息知,菱锰矿的主要成分是碳酸锰,含有Fe2O3、FeO、HgCO3?2HgO等杂质,向菱锰矿加硫酸,生成硫酸汞、硫酸锰、硫酸亚铁和硫酸铁,加液氯,将亚铁离子氧化为铁离子,通过调节pH使铁离子转化为氢氧化铁沉淀而除去,净化剂可将重金属离子转化为沉淀,净液主要含硫酸锰,电解时锰离子放电生成二氧化锰,然后利用铝热反应制备Mn。(1)向粗液1中加入的水最后需要蒸馏达到浓缩的目的,使溶质的浓度增大;(2)流程中用的空气是用膜分离法制备的富氧空气,其原理为空气中的氧气和氮气透过分离膜的能力不同;(3)粗液2中加净化剂(NH4)2S发生主要反应的离子方程式为Hg2++S2-=HgS↓;(4)净液主要含硫酸锰,电解时锰离子放电生成二氧化锰,则阳极反应式为Mn2++2H2O-2e-=MnO2+4H+;电解液循环利用是因回收未反应的Mn2+,提高二氧化锰的产率;(5)铝热法炼锰的化学方程式为3MnO2+4Al 2Al2O3+3Mn。
2Al2O3+3Mn。
考点:考查化学与技术。


科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com