
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[探究一] 实验方案:铝镁合金 测定生成气体的体积
测定生成气体的体积
实验装置如下图,问题讨论:

(1)反应完毕,每间隔1分钟读取气体体积,气体体积逐渐减小,直至不变。气体体积减小的原因是
(仪器和实验操作的影响因素除外)。
(2)为使测定结果尽可能精确,实验中应注意的问题除了检查装置的气密性、加入足量盐酸使合金完全溶解和按(1)操作外,请再写出两点:
①
②
(3)如果用分析天平准确称取0.51g镁铝合进行实验,测得生成气体体积为560 mL(已折算成标况下体积),请计算合金中镁的质量分数。(请写出计算过程)___________ ____________________________________________________________________________。
[探究二] 实验方案:称量Bg另一品牌铝镁合金粉末.放在如下图所示装置的惰性电热板上,通电使其充分灼烧。
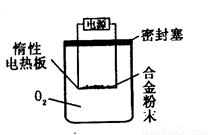
问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是 。
(2)用本方案进行实验时,装置中至少要充入O2的物质的量 mol(用含B的最简式表示)。
[实验拓展] 研究小组对某无色透明的溶液进行实验,发现该溶液跟铝反应时放出H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、NO3-,在下列两种情况下,可能存在于此溶液中的是:
①当与铝反应后生成Al3+时,原溶液可能大量存在的离子 。
②当与铝反应后生成[Al(OH)4]-时,原溶液可能大量存在的离子是 。
(12分) [探究一](1)反应放热,气体温度较高,温度降低时,气体体积减小。1分
(2)①调整量气管C的高度,使C中液面与B液面相平;②读数时保证视线与凹液面的最低点相平;(各1分)(3)47.1% (4分)
[探究二](1)灼烧后固体的质量 (1分) (2)B/36 (2分)
[实验拓展]①Mg2+、SO42-、H+ ②Ba2+、OH-、NO3-(各1分)
【解析】
试题分析:[探究一](1)活泼金属与酸的反应是放热反应,故气体体积减小的原因是反应放热,气体温度较高,温度降低时,气体体积减小。
(2)①要使容器中的压强相等才能计量准确,即调整量气管C的高度,使C中液面与B液面相平;②排除认为的原因,即读数时保证视线与凹液面的最低点相平。
(3)560 mL即0.025mol,Mg~~~H2↑、Al~~~3/2 H2↑,
24n(Mg)+27n(Al)=0.51、n(Mg) +3/2 n(Al)=0.025。解得n(Al)=0.01mol,n(Mg)=0.01mol。
m(Mg)= 24n(Mg)=0.024(g)。合金中镁的质量分数为0.024g/0.51g*100%=47.1%。
[探究二](1)欲计算镁的质量分数,该实验中还需测定的一种数据是:完全反应后生成的固体的质量。
(2)如果合金全是铝,消耗氧气是最少的,关系式为Al~~~3/4O2,经计算得装置中至少要充入O2的物质的量为B/36mol。
[实验拓展] (1) 生成Al3+,证明体系中存在H+
能与H+共同存在的是Ba2+,Cu2+,Mg2+,H+,SO42-,NO3-,Cl-
溶液无色,排除Cu2+
若存在NO3-,则不与Al反应产生H+,产生NO或者NO2,故而NO3-不存在
余下的Ba2+和SO42-不能同时存在
故而体系中存在Ba2+,Mg2+,H+,Cl-或者Mg2+,H+,Cl-,SO42-,无论哪种情况Ag+均不能存在,Ag2SO4和AgCl均溶解度不好
(2) 生成AlO2-,证明体系含OH-
2Al + 2OH- + 2H2O ="===" 2AlO2- + 3H2↑
含有OH-,则不能含有Mg2+(否则Mg(OH)2沉淀),不能有H+,不能有Ag+,不能有Cu2+,不能有HCO3-
剩余为Ba2+,SO42-,SO32-,NO3-,OH-和Cl-
溶液中必有阳离子,Ba2+
所以没有SO32-和SO42-
只剩下:Ba2+,NO3-,OH-和Cl-
考点:探究物质的组成或测量物质的含量 镁的化学性质 铝的化学性质
点评:主要考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 氢氧化钠溶液 |
| 盐酸 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| NaOH溶液 |
| 盐酸 |

 问题讨论:
问题讨论:查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液 |
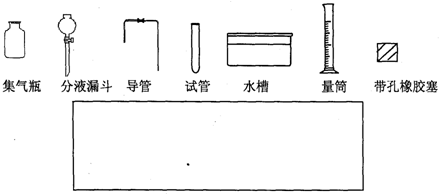
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市吴淞中学高二上学期期中考试化学试卷 题型:实验题
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
【探究一】实验方案:铝镁合金 测定剩余固体质量。
测定剩余固体质量。
问 题:实验中发生反应的化学方程式是
实验步骤:
(1)称取5.4g铝镁合金粉末样品,投入VmL 2、0mol·L-1NaOH溶液中,充分反应。NaOH溶液的体积V≥
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (填“偏高”或“偏低”)。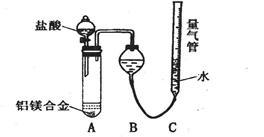
【探究二】实验方案:铝镁合金 测定生成气体的体积实验装置。
测定生成气体的体积实验装置。
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是: (填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①
② 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com