
| A. | 在NaNO3和NaCl混合溶液:H+、NH4+、SO42-、Cu2+ | |
| B. | 加入金属镁能产生H2的溶液:Na+、SO42-、Cu2+、NO3- | |
| C. | 常温下由水电离出的c(OH-)=10-12mol/L的溶液:Na+、SO32-、Cl-、Mg2+ | |
| D. | pH=2的溶液中:ClO-、K+、CH2CHO、SO42- |
分析 A、在NaNO3和NaCl混合溶液中,Na+、NO3-、Cl-与H+、NH4+、SO42-、Cu2+均不能反应;
B、加入金属镁能产生H2的溶液显酸性,且必须是非氧化性酸溶液;
C、常温下由水电离出的C(H+)=10-12mol•L-1的为酸性或者碱性溶液,镁离子能够与氢氧根离子反应生成氢氧化镁沉淀;
D、pH=2的溶液显酸性,H+能和ClO-生成弱电解质.
解答 解:A、在NaNO3和NaCl混合溶液中,Na+、NO3-、Cl-与H+、NH4+、SO42-、Cu2+均不能反应,故可以共存,故A正确;
B、加入金属镁能产生H2的溶液是酸溶液,含大量H+,但由于溶液中有NO3-,会形成HNO3溶液,和镁反应生成的不是氢气,故B错误;
C、常温下由水电离出的C(H+)=10-12mol•L-1的为酸性或者碱性溶液,如果是碱液,则镁离子能够与氢氧根离子反应生成氢氧化镁沉淀;如果是酸液,则SO32-会和
H+反应生成二氧化硫而不能共存,故C错误;
D、pH=2的溶液显酸性,含有的大量的H+能和ClO-生成弱电解质HClO而不能共存,且CH3CHO有强还原性,和ClO-能发生氧化还原反应而不能共存,故D错误.
故选A.
点评 本题考查离子共存的正误判断,该题是高考中的高频题,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能生成难溶物的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色等.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 14CO2与12CO2的化学性质不同 | B. | 14CO的摩尔质量等于30g | ||
| C. | 46g 14CO2气体的体积为22.4L | D. | 14C与12C、13C互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 3:2 | C. | 2:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 53g•mol-1 | B. | 106g•mol-1 | C. | 53 | D. | 106 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
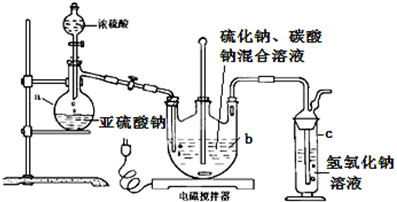
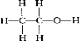 .
.| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com