
����Ŀ������2CrO42��+2H+ ![]() Cr2O72��+H2O�����ͼ��װ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7��ͼ�����Ҳ�缫���ӵ�Դ��_________��������Ʊ����̵��ܷ�Ӧ����ʽΪ_________���ⶨ����Һ��Na��Cr�ĺ�������Na��Cr�����ʵ���֮��Ϊa��b�����ʱNa2CrO4��ת����Ϊ_________����ѡ��������K2CO3�����ʵļ״���CH3OH��ȼ�ϵ�س䵱��Դ������ӦʽΪ________________��
Cr2O72��+H2O�����ͼ��װ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7��ͼ�����Ҳ�缫���ӵ�Դ��_________��������Ʊ����̵��ܷ�Ӧ����ʽΪ_________���ⶨ����Һ��Na��Cr�ĺ�������Na��Cr�����ʵ���֮��Ϊa��b�����ʱNa2CrO4��ת����Ϊ_________����ѡ��������K2CO3�����ʵļ״���CH3OH��ȼ�ϵ�س䵱��Դ������ӦʽΪ________________��
���𰸡��� 4Na2CrO4+4H2O![]() 2Na2Cr2O7+4NaOH+2H2��+O2�� ��2��
2Na2Cr2O7+4NaOH+2H2��+O2�� ��2��![]() ����100% CH3OH��6e��+3CO32��=4CO2+2H2O
����100% CH3OH��6e��+3CO32��=4CO2+2H2O
��������
�Ҳ�缫����H����������OH��������������Ӧ���Ҳ�Ϊ�����������Ϊ���������ӵ�Դ�ĸ��������ݷ�Ӧ����ʽ���㣻�״���CH3OH���ڸ�������������Ӧ��
����2CrO42��+2H��=Cr2O72��+H2O�����Na2CrO4��Һ��ȡNa2Cr2O7��Ӧ�����������½��У����Ҳ�缫����H����������OH��������������Ӧ���Ҳ�Ϊ�����������Ϊ���������ӵ�Դ�ĸ���������Ʊ����̵��ܷ�Ӧ����ʽΪ 4Na2CrO4+4H2O ![]() 2Na2Cr2O7+4NaOH+2H2��+O2��������뷴Ӧ�����ڵ�Na2CrO4Ϊ1mol����Ӧ��������xmol Na2CrO4ת��ΪNa2Cr2O7����������ʣ��Na2CrO4Ϊ��1-x��mol����Ӧ��n��Na��=2��1-x��mol��n��Cr��=��1-x��mol�����ɵ�Na2Cr2O7Ϊ
2Na2Cr2O7+4NaOH+2H2��+O2��������뷴Ӧ�����ڵ�Na2CrO4Ϊ1mol����Ӧ��������xmol Na2CrO4ת��ΪNa2Cr2O7����������ʣ��Na2CrO4Ϊ��1-x��mol����Ӧ��n��Na��=2��1-x��mol��n��Cr��=��1-x��mol�����ɵ�Na2Cr2O7Ϊ![]() mol����Ӧ��n��Na��=xmol��n��Cr��=xmol�����ݣ�Na��Cr�����ʵ���֮��Ϊa:b�����x=2-
mol����Ӧ��n��Na��=xmol��n��Cr��=xmol�����ݣ�Na��Cr�����ʵ���֮��Ϊa:b�����x=2-![]() ��ת����Ϊ
��ת����Ϊ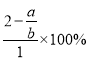 =��2-
=��2-![]() ����100%����ѡ��������K2CO3�����ʵļ״���CH3OH��ȼ�ϵ�س䵱��Դ������ӦʽΪCH3OH-6e��+3CO32��=4CO2+2H2O���ʴ�Ϊ������ 4Na2CrO4+4H2O
����100%����ѡ��������K2CO3�����ʵļ״���CH3OH��ȼ�ϵ�س䵱��Դ������ӦʽΪCH3OH-6e��+3CO32��=4CO2+2H2O���ʴ�Ϊ������ 4Na2CrO4+4H2O ![]() 2Na2Cr2O7+4NaOH+2H2��+O2������2-
2Na2Cr2O7+4NaOH+2H2��+O2������2-![]() ����100%��CH3OH-6e��+3CO32��=4CO2+2H2O��
����100%��CH3OH-6e��+3CO32��=4CO2+2H2O��


 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. 24 g þ��27 g���У�������ͬ��������
B. ͬ�������������ͳ����У���������ͬ
C. 1 mol��ˮ��1 molˮ�У���������Ϊ2��1
D. 1 mol�����1 mol��ϩ�У���ѧ������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ����0.1 mol��L��1 CuSO4��Һ480 mL�������в������������ʵ������֣���ʹ��������������
(1)ѡ����������ɱ�ʵ��������������У�������ƽ(��ȷ��0.1 g)��ҩ�ס��ձ�����Ͳ���������� ________��________�Լ�����������Ƭ����ֽ��
(2)���㣬Ӧѡ������________��
A����ҪCuSO4����8.0 g B����ҪCuSO4��5H2O����12.0 g
C����ҪCuSO4��5H2O����12.5 g D����ҪCuSO4����7.7 g
(3)��������������������������Һ��Ũ�Ȼ�________(����ƫ������ƫ����������Ӱ��������ͬ)��
(4)�ܽ⡢��ȴ����δ��ȴ����������ҺŨ�Ȼ�________��
(5)ת�ơ�ϴ�ӡ���δϴ�ӣ���������ҺŨ�Ȼ�________��
(6)���ݣ�ҡ�ȡ�
(7)����õ���Һ����һ��ʱ�����ָ�����Լ�ƿ�����ñ�ǩ��ע�����Ƶ�ʱ�䡢��Һ���Ƽ�Ũ�ȡ�

(8)�����ƹ����У�ijѧ���۲춨��ʱҺ�������ͼ��ʾ��������Һ��Ũ�Ȼ�________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��Ŧ�۵�����ִ��������й㷺Ӧ�ã���һ����п��أ���缫�ֱ���![]() ��
��![]() ���������ҺΪ
���������ҺΪ![]() ��Һ���缫��ӦΪ��
��Һ���缫��ӦΪ��![]() ��
��![]() ������������Ӧʽ�����������Ŀ��
������������Ӧʽ�����������Ŀ��

������������ȷ����_______��
![]() ����ʹ�ù����У�K+����Zn��
����ʹ�ù����У�K+����Zn��
![]() ��ʹ�ù����У�������
��ʹ�ù����У�������![]() �������·����
�������·����![]() ��
��
![]() ��
��![]() �Ǹ�����
�Ǹ�����![]() ������
������
![]() ��
��![]() �缫������ԭ��Ӧ��
�缫������ԭ��Ӧ��![]() �缫����������Ӧ
�缫����������Ӧ
��д����ص��ܷ�Ӧʽ��________________________________________________________________ ��
��ʹ��ʱ���������Һ��![]() ________��
________��
(2)Ǧ�����ǵ��͵Ŀɳ��͵�أ�����ܷ�ӦʽΪ��Pb+PbO2+4H++2SO42-2PbSO4+2H2O����ش��������⣺�ٷŵ�ʱ�������ĵ缫��Ӧʽ�� _____________________________________________________________________��
�ڵ��Һ��![]() ��Ũ�Ƚ���_______��
��Ũ�Ƚ���_______��
�۵����·ͨ��![]() ����ʱ�������ϸ��������������_______
����ʱ�������ϸ��������������_______![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʮ��������ѧ�����߶Ե��������̼�����������˹㷺������о���ȡ��һЩ��Ҫ�ɹ���
��֪2NO��g��+O2��g�� ![]() 2NO2��g���ķ�Ӧ���̷�������
2NO2��g���ķ�Ӧ���̷�������
��һ����2NO��g�� ![]() N2O2��g�� ���죩 H1<0��v1��=k1��c2��NO�� ��v1��=k1��c��N2O2��
N2O2��g�� ���죩 H1<0��v1��=k1��c2��NO�� ��v1��=k1��c��N2O2��
�ڶ�����N2O2��g��+O2��g�� ![]() 2NO2��g�� ������ H2< 0�� v2��=k2��c��N2O2��c��O2����v2��=k2��c2��NO2��
2NO2��g�� ������ H2< 0�� v2��=k2��c��N2O2��c��O2����v2��=k2��c2��NO2��
��2NO��g��+O2��g�� ![]() 2NO2��g���ķ�Ӧ������Ҫ����______��������һ���������ڶ���������Ӧ������
2NO2��g���ķ�Ӧ������Ҫ����______��������һ���������ڶ���������Ӧ������
��һ���¶��£���Ӧ2NO��g��+O2��g�� ![]() 2NO2��g���ﵽƽ��״̬����д����k1����k1����k2����k2����ʾ��ƽ�ⳣ������ʽK=____________��
2NO2��g���ﵽƽ��״̬����д����k1����k1����k2����k2����ʾ��ƽ�ⳣ������ʽK=____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ���ᱡ�ɴ���(![]() )���ܷ���ˮ�⡢��������ȥ��Ӧ
)���ܷ���ˮ�⡢��������ȥ��Ӧ
B. ��ȩ�ͱ�ϩȩ(![]() )����ͬϵ�������������ַ�Ӧ��IJ���Ҳ����ͬϵ��
)����ͬϵ�������������ַ�Ӧ��IJ���Ҳ����ͬϵ��
C. ���ۺ���ά�����������ȫˮ���IJ��ﶼ��������
D. CH3COOCH2CH3��CH3CH2COOCH3��Ϊͬ���칹�壬1H��NMR����ʾ���߾������ֲ�ͬ����ԭ����������ԭ�ӵı�����ͬ���ʲ�����1H��NMR������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��CPAE�Ƿ佺����Ҫ���Գɷ֣�Ҳ���ɿ�����ϳ�.����˵������ȷ����

A�����������������̼ԭ�ӿ��ܴ���ͬһ��ƽ����
B��1molCPAE����������ˮ��Ӧ���������3molBr2
C��1mol���Ҵ���O2����ȫȼ�գ�������10molO2
D��1molCPAE��������NaOH��Һ��Ӧ���������3molNaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������軯�صĻ�ѧʽΪK4[Fe(CN)6]��һ���ú�NaCN��ˮ�ϳɸû��������Ҫ����������ͼ��

�����ݹ�������ͼ�е���Ϣ���ش��������⣺
���ڡ����ӡ���������������Ҫ�ɷ�Ϊ________(�ѧʽ)��
���ڡ���Ӧ�����з�������Ҫ��Ӧ�Ļ�ѧ����ʽΪ_______________________��
����ͬ�¶����ܽ�ȣ�Na4[Fe(CN)6]________K4[Fe(CN)6](���������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D����ѧ��ѧ�г��������ֲ�ͬ���ӣ�����֮�������ͼ��ʾ��ת����ϵ����Ӧ�����Ѿ���ȥ����
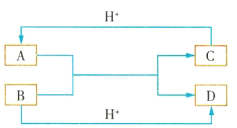
��1����A��B��C��D����10�������ӣ���д��A��D�Ļ�ѧʽ��A___��D___��
��2����A��C����18�������ӣ���AΪ�����ӣ�B��D����10�������ӣ���A��B����Һ�з�Ӧ�����ӷ���ʽΪ___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com