
下列描述中正确的是
A.强酸与强碱反应都是放热反应
B.氧化还原反应一定都是放热反应
C.放热反应的反应速率总是大于吸热反应的反应速率
D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的 不同
不同
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年河北邯郸魏县一中、曲周县一中高二上期中化学试卷(解析版) 题型:选择题
如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液。则A、B、C为

A. A是Zn,B是Cu,C是稀H2SO4
B. A是Cu,B是Zn,C是稀H2SO4
C. A是Fe,B是Ag,C是稀AgNO3溶液
D. A是Ag,B是Fe,C 是稀 AgNO3溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省盐城市高一上学期期中考试化学试卷(解析版) 题型:选择题
将白醋、食用油、食盐、酒精分别放入水中,不能形成溶液的是
A.白醋 B.食用油
C.食盐 D.酒精
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上第二次月考化学试卷(解析版) 题型:填空题
以下是25℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为_______(填化学式)而除去。
(2)①中加入的试剂应该选择_________为宜,其原因是_____________。
(3)②中除去Fe3+所发生的离子方程式为__________________________。
(4)下列与方案③相关的叙述中,正确的是__________________(填字母,多选不得分,少选得1分)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上第二次月考化学试卷(解析版) 题型:填空题
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的比值将________(填“增大”、“减小”或“无法确定”)。
的比值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)(填“大于”、“小于”或“等于”,下同)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)________V(乙)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省盐城市高二上学期期中考试化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.水晶和陶瓷的主要成分都属于硅酸盐
B.单质硅是制造光导纤维的材料
C.硅酸钠是制备硅胶和木材防火剂的原料
D.工业上用盐酸刻蚀玻璃
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上第二次月考化学试卷(解析版) 题型:选择题
两气体A和B的摩尔质量之比为3:1,则它们在同温、同压、同体积时的分子个数比应为
A、1:1 B、1:3 C、3:1 D、9:1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是
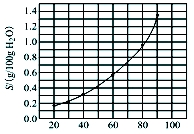
A.溴酸银的溶解是吸热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-3
D.若硝酸钾中含有少量溴酸银,可用它们的溶解度随温度变化的差异进行分离
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州遵义航天中学高二上第三次月考化学卷(解析版) 题型:?????
硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发展水平的一种标志。目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2 2SO3,的说法不正确的是( )
2SO3,的说法不正确的是( )
A.该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零
C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com