
【题目】下列说法中正确的是( )
A. 用砂纸打磨过的铝箔在空气中加热,会熔化并剧烈燃烧
B. 向盛水的烧杯中投入一大块钠,这样现象更明显
C. 铁在纯氧中点燃,会剧烈燃烧,火星四射,生成氧化二铁
D. 铝制容器不可以用来长期存放酸性,碱性或咸的食物
 互动课堂系列答案
互动课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于化学反应及相关概念的叙述正确的是
A.碱性氧化物一定是金属氧化物
B.溶于水能导电的化合物一定是电解质
C.冰与水之间的相互转化是化学变化
D.有单质生成的反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.非金属元素(稀有气体元素除外)都是主族元素,单质在反应中都只能作氧化剂
B.常温下,1 mol氯气和足量稀NaOH溶液完全反应转移1mol电子
C.在加热条件下,用乙醇除去乙酸乙酯中的乙酸
D.硫酸铜溶液显酸性的原因:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某工厂的工业废水中含有大量的FeSO4和较多的Fe3+和Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。实验室模拟该工业流程如图:
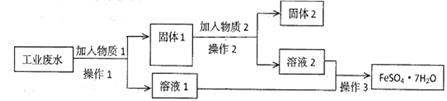
(1)检验废水中的Fe2+,实验室中用酸性KMnO4溶液检验,发生反应的离子方程式为________________________。
(2)加入过量物质1后,发生反应的离子方程式为___________________________。
(3)固体2是_____________________,实验室为长期保存硫酸亚铁溶液往往向其溶液中加入_______________________。
Ⅱ.工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、FeO、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________(填化学式)。
(2)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2也被氧化,写出其被氧化的化学方程式__________________________。
(3)写出通入过量CO2生成沉淀A时反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是( )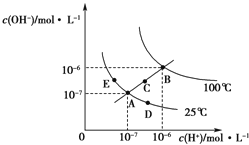
A.图中五点KW间的关系:B=C=A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废铁屑表面常有铁锈(成分为Fe2O3),并沾有油污。某校研究性学习小组设计实验方案,按以下①~④步骤用废铁屑制备绿矾(FeSO4·7H2O)晶体。
废铁屑 ![]() 铁屑
铁屑![]() 溶液(留有少量铁屑)
溶液(留有少量铁屑)![]() 滤液
滤液 ![]() 绿矾晶体
绿矾晶体
根据该实验方案,回答下列问题:
(1)步骤①中废铁屑与NaOH溶液共热的目的是。
(2)步骤②中烧杯底部留有少量铁屑的理由是。
说明剩余铁屑作用的离子方程式为。
(3)在步骤③中,该小组采用如图抽气过滤(减压过滤)装置代替普通漏斗,其目的是;。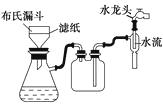
(4)检查步骤③的滤液中没有Fe3+的方法是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)、硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]是重要的化学化工试剂。工业上常利用机械加工行业产生的废铁屑为原料制备。
请回答下列问题:
(1)下图所示装置用于制备绿矾。其中锥形瓶中盛放的药品或原料是 , 集气瓶的作用是;烧杯中主要发生:①CuSO4+H2S=CuS↓+H2SO4 , ②4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu,则烧杯中盛放的试剂是 , 其作用是。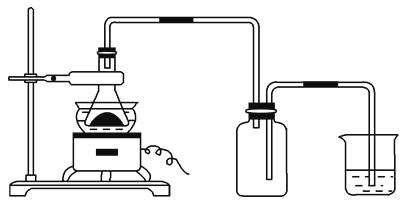
(2)下图所示装置用于制备硫酸亚铁铵。在0~60 ℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,冷却混合液至室温便析出硫酸亚铁铵。具体操作:①打开活塞 , 关闭活塞 , 从分液漏斗滴入6 mol·L-1H2SO4到250 mL锥形瓶,充分反应。②待锥形瓶中的铁屑快反应完时,关闭活塞 , 打开活塞。③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。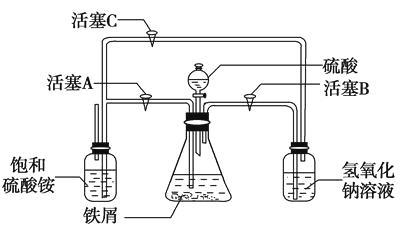
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤相同,制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
序号 | 反应物用量 | 产品质量 |
1 | n(H2SO4)∶n(Fe)>1∶1 | 介于Ⅰ级~Ⅱ级之间 |
2 | n(H2SO4)∶n(Fe)<1∶1 | 优于Ⅰ级 |
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制过量为最佳。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的性质的叙述中,不正确的是( )
A.苯是无色带有特殊气味的液体
B.常温下苯是一种不溶于水且密度小于水的液体
C.苯在一定条件下能与溴发生取代反应
D.苯不具有典型的双键所应具有的发生加成反应的特性,故不可能发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com