
(10��)��֪ij��Һ��ֻ����OH����H+��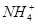 ��Cl���������ӣ�ijͬѧ�Ʋ�������Ũ�ȴ�С˳�����������ֹ�ϵ��
��Cl���������ӣ�ijͬѧ�Ʋ�������Ũ�ȴ�С˳�����������ֹ�ϵ��
��c(Clһ)��c(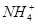 )��c(H��)��c(OH��)��c(Clһ)��c(
)��c(H��)��c(OH��)��c(Clһ)��c(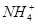 )��c(OH��)��c(H��)
)��c(OH��)��c(H��)
��c(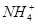 )��c(Cl-)��c(OH��)��c(H��)��c(Cl-)��c(H��)��c(
)��c(Cl-)��c(OH��)��c(H��)��c(Cl-)��c(H��)��c(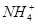 )��c(OH��)
)��c(OH��)
��д���пհף�
(1)����Һ��ֻ�ܽ���һ�����ʣ����������_________________��������������Ũ�ȵĴ�С˳��Ϊ______________________(�����)��
(2)��������ϵ�Т�����ȷ�ģ�����Һ�е�����Ϊ____________________________________��
��������ϵ�Т�����ȷ�ģ�����Һ�е�����Ϊ_______________________________________��
(3)������Һ���������ȵ�ϡ����Ͱ�ˮ��϶��ɣ���ǡ�û�Ϻ���Һ�����ԣ�����ǰc(HCl)_______________c(NH3��H2O)(����ڡ���С�ڡ����ڡ�)��
 ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д� �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(10��)��֪ij��Һ��ֻ����OH����H+��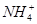 ��Cl���������ӣ�ijͬѧ�Ʋ�������Ũ�ȴ�С˳�����������ֹ�ϵ��
��Cl���������ӣ�ijͬѧ�Ʋ�������Ũ�ȴ�С˳�����������ֹ�ϵ��
��c(Clһ)��c(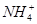 )��c(H��)��c(OH��)��c(Clһ)��c(
)��c(H��)��c(OH��)��c(Clһ)��c(![]() )��c(OH��)��c(H��)
)��c(OH��)��c(H��)
��c(![]() )��c(Cl-)��c(OH��)��c(H��)��c(Cl-)��c(H��)��c(
)��c(Cl-)��c(OH��)��c(H��)��c(Cl-)��c(H��)��c(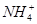 )��c(OH��)
)��c(OH��)
��д���пհף�
(1)����Һ��ֻ�ܽ���һ�����ʣ����������_________________��������������Ũ�ȵĴ�С˳��Ϊ______________________(�����)��
(2)��������ϵ�Т�����ȷ�ģ�����Һ�е�����Ϊ____________________________________��
��������ϵ�Т�����ȷ�ģ�����Һ�е�����Ϊ_______________________________________��
(3)������Һ���������ȵ�ϡ����Ͱ�ˮ��϶��ɣ���ǡ�û�Ϻ���Һ�����ԣ�����ǰc(HCl)_______________c(NH3��H2O)(����ڡ���С�ڡ����ڡ�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�����ʡ�人����У��һ��ѧ������ͳ����ѧ�Ծ����������� ���ͣ�������
(10��) (1)��֪ij��Ӧ�ĸ�����Ũ���������£�
_ 


��ʼŨ�ȣ� ���� 1.5 1.0 0
���� 1.5 1.0 0
2sĩŨ�ȣ� ���� 0.9 0.8 0.4
���� 0.9 0.8 0.4
���a= ��b= ��
��2s��B��ת����= ��
(2)��̼������Ƭ��200mL 1.5mol/L��ϡ������ɵ�ԭ����У�����̼���ϲ�������3.36L����״����ʱ����
���� mol���Ӵ� ͨ�����ߵ� (���Ƭ����̼����)��
�ܴ�ʱ��Һ��H+�����ʵ���Ũ��Ϊ ����������Һ����仯����
(3)��2.3g�����Ʒ���������m g��ˮ��D2O���У���ȫ��Ӧ��������Һ�����ʵ����������� ���ú�m�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�����ʡ�人����У��һ��ѧ������ͳ����ѧ�Ծ��������棩 ���ͣ�������
(10��) (1)��֪ij��Ӧ�ĸ�����Ũ���������£�
_



��ʼŨ�ȣ� ����
1.5
1.0 0
����
1.5
1.0 0
2sĩŨ�ȣ� ����
0.9 0.8
0.4
����
0.9 0.8
0.4
���a= ��b= ��
��2s��B��ת����= ��
(2)��̼������Ƭ��200mL 1.5mol/L��ϡ������ɵ�ԭ����У�����̼���ϲ�������3.36L����״����ʱ����
���� mol���Ӵ� ͨ�����ߵ� (���Ƭ����̼����) ��
�ܴ�ʱ��Һ��H+�����ʵ���Ũ��Ϊ ����������Һ����仯����
(3)��2.3g�����Ʒ���������m g��ˮ��D2O���У���ȫ��Ӧ��������Һ�����ʵ����������� ���ú�m�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�찲��ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
(10��)(1)��֪���б仯�����У�0.2 mol R2O72-��0.2 mol K2SO3ǡ�÷�Ӧ����R����ԭ�ļ�̬Ϊ____��
(2)��100 mL 0.100 mol��L��1��FeBr2��Һ��ͨ��Cl2����ҪʹFe2���պ÷�Ӧ��ȫ�������״����Cl2________ mL��
(3)ij��Ӧ�з�Ӧ�����������У�AsH3��H2SO4��KBrO3��K2SO4��H3AsO4��H2O��һ��δ֪����X.
����֪KBrO3�ڷ�Ӧ�еõ����ӣ���÷�Ӧ�Ļ�ԭ����______________________��
����֪0.2mol KBrO3�ڷ�Ӧ�еõ�1mol��������X����X�Ļ�ѧʽΪ______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com