
【题目】酸性KMnO4在生产、生活、卫生医疗中常用作消毒剂,高锰酸钾造成的污渍可用还原性的草酸(H2C2O4 )去除,Fe(NO3)3也是重要氧化试剂,下面是对这两种氧化剂性质的探究。
(1)取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量的是________mol。
(2)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.395 g KMnO4样品溶解酸化后,用0.100 mol/L标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在________(填“酸式”或“碱式”)滴定管中。实验中,滴定至终点时消耗Na2S2O3溶液12.50 mL,则该样品中KMnO4的质量分数是________。(有关离子方程式为:8MnO4-+5S2O32-+14H+=8Mn2++10SO42-+7H2O)
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。溶液先变为浅绿色的离子方程式是_______________,又变为棕黄色的离子方程式是__________。
【答案】0.16 碱式 80.0% 2Fe3++SO32-+ H2O === 2Fe2++SO42-+2H+ 3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
【解析】
(1)n(KI)=0.06mol,与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则n(I2)=n(KIO3)=0.02mol,结合化合价的变化计算转移的电子的数目;
(2)Na2S2O3溶液水解显碱性;根据方程式中 8MnO4---5S2O32-,计算消耗的高锰酸钾的物质的量,再计算样品中KMnO4的质量分数;
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,原因是Fe3+与SO32-发生氧化还原反应生成Fe2+和SO42-,反应后溶液呈酸性,则在酸性条件下NO3-与Fe2+反应生成Fe3+,过一会又变为棕黄色。
(1)300mL0.2mol/L的KI溶液中:n(KI)=0.2mol/L×0.3L=0.06mol,与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则n(I2)=n(KIO3)=0.02mol,失电子的物质的量为:2×0.02mol+0.02mol×[5-(-1)]=0.16mol,即转移电子的物质的量为0.16mol,故答案为:0.16;
(2)Na2S2O3溶液水解显碱性,标准Na2S2O3溶液应盛装在碱式滴定管中;测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.395gKMnO4样品溶解酸化后,用0.100mol/L标准Na2S2O3溶液进行滴定,滴定至终点时,溶液紫红色褪去且30秒内颜色不再变化;根据方程式中 8MnO4-----5S2O32-得n(KMnO4)=![]() ×8=0.002mol,m(KMnO4)=158g/mol×0.002mol=0.316g,质量分数=
×8=0.002mol,m(KMnO4)=158g/mol×0.002mol=0.316g,质量分数=![]() ×100%=80%,故答案为:碱式;80%;
×100%=80%,故答案为:碱式;80%;
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,原因是Fe3+与SO32-发生氧化还原反应生成Fe2+和SO42-,反应的离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,反应后溶液呈酸性,则在酸性条件下NO3-与Fe2+反应生成Fe3+,过一会又变为棕黄色,反应的离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故答案为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=___________________。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“不变”),原因是_____________________________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普拉西坦是一种能改善记忆、抗健忘的中枢神经药。下列关于普拉西坦的说法正确的是 ( )
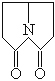
A. 一氯取代物只有5种
B. 二氯取代物只有5种
C. 可发生水解反应
D. 与2-氨基环丁二烯丙酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是:
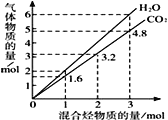
①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷⑤可能有甲烷 ⑥可能有乙炔(C2H2)
A. ②④ B. ②③⑥ C. ②⑥ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性废水中的NH4+可在一定条件下利用硝酸盐菌转化为NO3-,再用图示的电化学装置除去NO3-下列有关说法正确的是
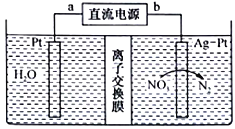
A. a端是直流电源的负极
B. 该装置把化学能转化为电能
C. 图中离子交换膜应为阴离子交换膜
D. 阴级的电极反应式为2NO3-+12H++10e-=N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表。忽略溶液体积变化,下列叙述不正确的是( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
A. 2 min时H2O2的浓度c(H2O2)=0.314mol/L
B. 0~4 min的平均反应速率v(H2O2)=3.75×10-2mol/(L·min)
C. 6~10 min,过氧化氢的平均反应速率v(H2O2)=2.75×10-2mol/(L·min)
D. 反应到6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]()
![]() 2Z(g) 、②2M(g)
2Z(g) 、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图示:
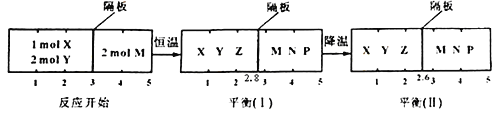
下列判断正确的是
A. 反应①的正反应是吸热反应
B. 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C. 达平衡(I)时,X的转化率为![]()
D. 在平衡(I)和平衡(II)中M的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国三峡工程所提供的清洁、廉价、可再生的水电,相当于每年燃烧3000万吨原煤的火力发电厂产生的电能,因此三峡工程有助于控制
①温室效应 ②S02的排放 ③白色污染 ④臭氧空洞
A. ①②③④ B. ①②③ C. ①②④ D. ①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com