

| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/mol | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | |
分析 (1)根据方程式3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)△H=-1591.2kJ/mol,可知每转移12mol电子,放出1591.2kJ热量,据此计算;
(2)①根据v=$\frac{△c}{△t}$计算v(H2),再根据速率之比等于化学计量数之比计算v(CO2);
②a.容器内CO、H2O、CO2、H2的浓度不再变化,则说明反应处于平衡状态;
b.恒温、恒容条件下,气体的总物质的量始终不变,压强始终不变;
c.恒容条件下,反应物和产物都是气体,密度始终不变;
d.υ正(CO)=υ逆(CO2),转化成CO2的正、逆反应速率相等;
e.该反应气体的物质的量不变,气体的质量也不变,所以反应过程中气体的平均相对分子质量不变;
③c到达平衡,而b点未达到平衡,正反应速率减小,逆反应速率增大至相等;该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行;
(3)负极发生氧化反应,根据电子守恒求消耗的氢氧根离子浓度.
解答 解:(1)根据方程式3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)△H=-1591.2kJ/mol,可知每转移12mol电子,放出1591.2kJ热量,所以每转移1mole-,可放出的热量为132.6kJ,
故答案为:132.6kJ;
(2)①v(H2)=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15mol/(L.min),速率之比等于化学计量数之比,则v(CO2)=v(H2)=0.15mol/(L.min),
故答案为:0.15mol/(L.min);
②a.容器内CO、H2O、CO2、H2的浓度不再变化,则说明反应处于平衡状态,故a正确;
b.恒温、恒容条件下,气体的总物质的量始终不变,压强始终不变,故b错误;
c.恒容条件下,反应物和产物都是气体,密度始终不变,故c错误;
d.υ正(CO)=υ逆(CO2),转化成CO2的正、逆反应速率相等,说明反应处于平衡状态,故d正确;
e.该反应气体的物质的量不变,气体的质量也不变,所以反应过程中气体的平均相对分子质量不变,所以不能说明反应是否处于平衡状态,故e错误,
故选:ad;
③c到达平衡,而b点未达到平衡,正反应速率减小,逆反应速率增大至相等,故b点υ正>υ逆;
该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行,故t3~t4时刻,H2O(g)的转化率降低,
故答案为:>;该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行;
(3)负极发生氧化反应,负极CH3OH-6e-+H2O=CO2+6H+,依据电子守4OH-~O2~4e-,当消耗560mLO2(标准状况下)时即$\frac{0.56}{22.4}$=0.025mol,依据电子守恒4OH-~O2~4e-,则消耗的氢氧根离子物质的量为0.025mol×4=0.1mol,所以溶液中氢离子的浓度为:$\frac{0.1}{1}$=0.1mol/L,故PH=1,
故答案为:CH3OH-6e-+H2O=CO2+6H+;1.
点评 本题考查反应速率计算、化学平衡状态的判断、电极反应式的书写和根据电极反应式的计算等,难度中等,是一道综合题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 将少量碳酸钠溶液滴加到盐酸中 CO32-+2H +═H2O+CO2↑ | |
| B. | 向明矾中加入氢氧化钡使硫酸根完全沉淀 Ba2++SO42-═BaSO4↓ | |
| C. | 苯酚钠中通入少量CO2 C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| D. | 向石灰乳中通入过量的SO2 OH-+SO2═HSO3- |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是
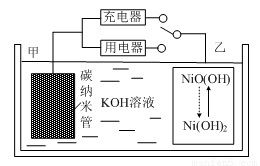
A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为:
NiO(OH)+H2O+e-=Ni(OH)2+OH-
C.充电时,电池的碳电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
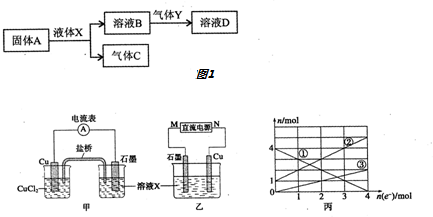
 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
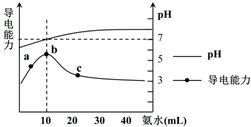
| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | b点溶液pH=7说明NH4R没有水解 | |
| C. | c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b-c任意点溶液均有c(H+)•c(OH-)=Kw=1.0×10-14 mol2•L-2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com