
| A. | 此时水的电离程度并不是最大 | |
| B. | 混合溶液中的离子浓度:c(NH4+)=c(Cl-)>c(H+)=c(OH-) | |
| C. | 此时溶液中NH3•H2O的浓度为$\frac{1}{2}$(b-0.01)mol.L-1 | |
| D. | 用含b的代数式不能表示25℃时NH3•H2O的电离常数 |
分析 A.当氨水与盐酸恰好反应时生成氯化铵溶液,铵根离子水解促进了水的电离,此时水的电离程度最大,溶液显示酸性;
B.溶液显中性,则c(H+)=c(OH-),根据电荷守恒分析各离子浓度大小;
C.溶液中(Cl-)=0.005mol/L,c(H+)=c(OH-)=10-7mol/L,已知电荷守恒c(H+)+c(NH4+)=c(Cl-)+c(OH-),则c(NH4+)=c(Cl-)=0.005mol/L,c(NH3•H2O)=$\frac{b}{2}$mol/L-c(NH4+)=$\frac{b-0.01}{2}$mol/L=$\frac{1}{2}$(b-0.01)mol/L,c(OH-)=10-7mol/L;
D.根据C可知c(H+)、c(OH-)、c(NH3•H2O),然后根据Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$可计算25℃时NH3•H2O的电离常数.
解答 解:A.在一水合氨与氯化氢恰好反应生成氯化铵溶液时,铵根离子在溶液中部分水解,促进了水的电离,水的电离程度最大,溶液显示酸性,当溶液显示中性时,氨水稍稍过量,水的电离程度小于二者恰好反应时水的电离程度,故A错误;
B.已知电荷守恒c(H+)+c(NH4+)=c(Cl-)+c(OH-),溶液显中性,则c(H+)=c(OH-),所以c(NH4+)=(Cl-),此时溶液中离子浓度大小为:c(NH4+)=c(Cl-)>c(H+)=c(OH-),故B正确;
C..溶液中(Cl-)=0.005mol/L,c(H+)=c(OH-)=10-7mol/L,已知电荷守恒c(H+)+c(NH4+)=c(Cl-)+c(OH-),则c(NH4+)=c(Cl-)=0.005mol/L,c(NH3•H2O)=$\frac{b}{2}$mol/L-c(NH4+)=$\frac{b-0.01}{2}$mol/L=$\frac{1}{2}$(b-0.01)mol/L,故C正确;
D.溶液中(Cl-)=0.005mol/L,c(H+)=c(OH-)=10-7mol/L,c(NH3•H2O)=$\frac{1}{2}$(b-0.01)mol/L,c(OH-)=10-7mol/L,则Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{0.05×1×1{0}^{-7}}{\frac{1}{2}(b-0.01)}$=$\frac{1{0}^{-9}}{b-0.01}$,故D错误;
故选D.
点评 本题考查了酸碱混合的定性判断及定量计算,题目难度稍大,明确溶液中的电荷守恒、电离常数的计算是解答本题关键,注意把握溶液酸碱性与溶液pH的关系,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:推断题
| 族 周期 | IA | 0族 | ||||||
| 1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
 .
.| 序号 | 条件 | 现象 | 结论 | ||
| 温度/℃ | 催化剂 | ||||
| 第一组 | 1 | 40 | FeCl3溶液 | 快速产生大量气泡 | 相同条件下,温度升高,化学反应速率加快 |
| 2 | 20 | A | 缓慢产生适量气泡 | ||
| 3 | 5 | FeCl3溶液 | 缓慢产生极少量气泡 | ||
| 第二组 | 4 | t | MnO2 | 快速产生大量气泡 | |
| 5 | 20 | 无 | 缓慢产生极少量气泡 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
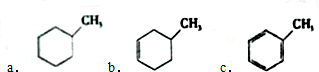
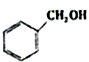 c.
c.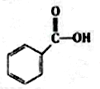
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铁粉,铁粉不溶解 | B. | 滴入 NaNO3溶液,铜片溶解 | ||
| C. | 加入银粉,银粉不溶解 | D. | 滴入 NaHCO3溶液,有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 表是元素周期表的前三周期:
表是元素周期表的前三周期:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | J |
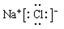 ,A、G、E形成的化合物中含有的化学键类型为离子键、共价键.
,A、G、E形成的化合物中含有的化学键类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛与甲酸甲酯 | B. | 1-戊烯与2-甲基-1-丙烯 | ||
| C. | 1-丁醇与甲醚 | D. | 丙酸与甲酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是H2O和CO反应生成CO2和H2过程中的能量变化示意图.由图可知,CO2和H2的总能量小于(填“大于”、“小于”或“等于”)H2O和CO的总能量,则该反应是放热(填“吸热”或“放热”)反应.
20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是H2O和CO反应生成CO2和H2过程中的能量变化示意图.由图可知,CO2和H2的总能量小于(填“大于”、“小于”或“等于”)H2O和CO的总能量,则该反应是放热(填“吸热”或“放热”)反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Na+、CO32-、SO42- | B. | Mg2+、Cl-、Na+、SO42- | ||
| C. | K+、Cl-、HCO3-、NO3- | D. | K+、Na+、Fe2+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com