
【题目】某反应的△H=+100kJmol﹣1 , 下列有关该反应的叙述正确的是( )
A.正反应活化能小于100 kJmol﹣1
B.逆反应活化能一定小于100 kJmol﹣1
C.正反应活化能不小于100 kJmol﹣1
D.正反应活化能比逆反应活化能小100 kJmol﹣1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如右图所示,则下列化学反应属于氧化还原反应但不包含在1,2,4范围内的是( )

A. Cl2+2KBr=Br2+2KCl B. 2NaHCO3![]() Na2CO3+H2O+CO2
Na2CO3+H2O+CO2
C. 4Fe(OH)2+O2+2H2O=4Fe(OH)3 D. 2Na2O2+2CO2=2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,A和B浓度比c(A):c(B)=3:5,C的平均反应速率是0.1mol/(Lmin).
(1)A在5min末的浓度是多少?
(2)B的平均反应速率是多少?
(3)D的平均反应速率是多少?
(4)x值是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,有关说法不正确的是( )
A. 试管a中实验可以证明SO2具有还原性 B. 试管b中溶液褪色,说明SO2具有漂白性
C. 试管c中能产生白色沉淀,说明SO2具有氧化性 D. 试管d中能产生白色沉淀,该沉淀不溶于稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2 L苯中所含C-H键数目为3NA
B. 7.8g Na2S和Na2O2组成的混合物,所含阴离子总数为0.1NA
C. 1 mol Cl2发生反应时,转移的电子数一定为2NA
D. 常温下,pH=2的H2SO4溶液中所含H+数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不粘锅的内壁有一薄层为聚四氟乙烯的涂层,用不粘锅烹烧饭菜时不易粘锅,下列关于聚四氟乙烯的说法正确的是( )
A.聚四氟乙烯分子中含有双键
B.聚四氟乙烯的单体不是饱和烃
C.聚四氟乙烯中氟的质量分数是76%
D.聚四氟乙烯的化学活泼性很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法不正确的是( )
A.置换反应一定是氧化还原反应B.复分解反应一定是非氧化还原反应
C.分解反应一定是氧化还原反应D.化合反应不一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要的合金材料和催化剂,其储氢合金可作为一种新型锌离子电池的负极材料,该电池以Zn(CF3SO3)2为电解质,以有缺陷的阳离子型ZnMn2O4为电极,成功获得了稳定的大功率电流。
(1)基态钒原子的价电子排布式为_______,其排布时能量最高的电子所占据能级的原子轨道有_______个伸展方向。
(2)VO2+与 可形成配合物。
可形成配合物。 中,三种非金属元素的电负性由大到小的顺序为_______ (用元素符号表示)。
中,三种非金属元素的电负性由大到小的顺序为_______ (用元素符号表示)。
(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为_______。与CN-互为等电子体的一种分子的化学式为________ 。
(4)三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF5、H2O2等为主要原料来制取。
①H2O2分子中O原子的杂化方式为_______。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为_______。
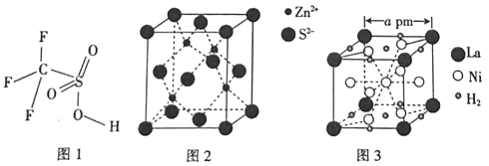
(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2所示,该晶胞中S2-的配位数为_________。
(6)镧镍合金是重要的储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为_________。
②该镧镍合金储氢后氢的密度为_________(用NA表示阿伏加德罗常数的数值)g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com