
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

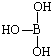 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)钒在元素周期表位于第_________周期,第_________族。
(2)钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的化学式为K2H6U2V2O15(其中钒元素的化合价为+5)。若用氧化物的形式表示,该化合物的化学式为___________。
(3)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成![]() ,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应的化学方程式:
,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应的化学方程式:
_______![]() +________H
+________H![]() _______VO++_______CO2+________H2O
_______VO++_______CO2+________H2O
其中还原剂是_________;若反应消耗
(4)工业上由V2O5冶炼金属钒常用铝热剂法。试用化学方程式表示出来_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com