
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟 工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用 干燥的N2赶尽Cl2,将收集器密封。
干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为_______________________________________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是__________________________________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)____________。
(4)装置B中冷水浴的作用为______________________________________________;
装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:_________________________________________。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为_________________________________________
________________________________________________________________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为____________________。
(8)综合分析实验 Ⅱ 的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;
②_________________________________________________ _______________________。
_______________________。
答案 (1)2Fe+3Cl2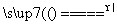 2FeCl3
2FeCl3
(2)在沉积的FeCl3固体下方加热
(3)②⑤
(4)冷却,使FeCl3沉积,便于收集产品 干燥管
K3[Fe(CN)6]溶液
(6)2Fe3++H2S===2Fe2++S↓+2H+
(7)Fe2+-e-===Fe3+
(8)FeCl3得到循环利用
解析 (1)装置A中进行的是Fe与Cl2制取FeCl3,反应的化学方程式为2Fe+3Cl2 2FeCl3。
2FeCl3。
(2)由于FeCl3沉积在反应管A右端,时间长了会堵塞,所以应在此处进一步加热使FeCl3再次升华进入收集装置。
(3)通入干燥氯气可排出空气以及其中所含的水蒸气,反应完毕后将多余Cl2赶出,将收集器密封以防吸收空气中的水蒸气从而避免了FeCl3的潮解。
(4)通过冷水浴将升华的FeCl3冷却收集,Fe2+的检验可通过与赤铁盐(K3[Fe(CN)6])生成蓝色沉淀(腾化盐)的方法来完成。
(6)Fe3+与H2S的氧化 还原反应的离子方程式的书写应注意得失电子守恒与电荷守恒。
还原反应的离子方程式的书写应注意得失电子守恒与电荷守恒。
(7)、(8)电解FeCl2溶液,通过阴极:2H++2e-===H2↑
阳极:Fe2+- e-===Fe3+来完成溶液中FeCl3的循环利用。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
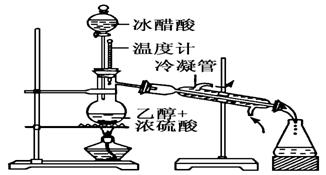
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其中浓硫酸作用的是______________________________________
(2)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1 mol乙酸乙酯?________(填能、否)
(3)写出乙酸与小苏打溶液反应的离子方程式______________________________
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
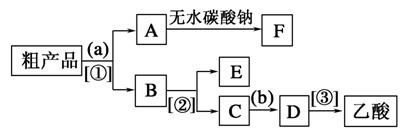
试剂a是__________ ,分离方法②是________
查看答案和解析>>
科目:高中化学 来源: 题型:
芳香烃分子式C9H12,同分异构体有( )种,其中苯环上的一溴代物只有两种的同分异构体有( )种。
A.8种;2种 B.8种;3种 C.7种;3种 D.7种;2种
查看答案和解析>>
科目:高中化学 来源: 题型:
要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时,最佳顺序为 ( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A.①③ B.③② C.③① D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有下列离子组的溶液中,加入Fe(NO3)2固体后,仍然能够大量共存的离子组是( )
A.K+、SO 、NH
、NH 、CO
、CO B.K+、Ba2+、OH-、Cl-
B.K+、Ba2+、OH-、Cl-
C.Na+、H+、Cl-、S O
O D.Na+、Mg2+、Cl-、
D.Na+、Mg2+、Cl-、 NO
NO
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下。


已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的________沉淀,该工艺中“搅拌”的作用是__________。
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成聚合离子Fe2(OH) 。该水解反应的离子方程式为__________________。
。该水解反应的离子方程式为__________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO 。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母序号)。
。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母序号)。
A.氯水 B.KSCN溶液
C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在以下四种溶液中,各离子一定能大量共存的是:
A.滴加酚酞试液显红色的溶液:Fe3+、NH4+、Cl—、CO32—
B.含溶质为MgCl2的溶液:K+、NO3—、SO42—、Al3+
C.水电离出来的c(H+)=10—13mol/L的溶液:K+、Na+、HCO3—、Br—
D.pH=1的溶液: Fe2+、Na+、I—、NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的分子式为C9H9ClO2 ,分子中含有1个苯环,苯环上有两个取代基,并能与NaHCO3溶液反应的同分异构体的数目为(不考虑立体异掏)
A.12种 B. 15种 C.18种 D. 21种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com