
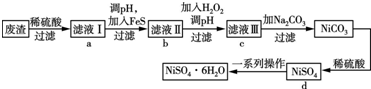
分析 废渣(除含镍外,还含有Cu、Zn、Fe等元素的化合物杂质),在硫酸溶解后过滤后除去不溶性物质,滤液Ⅰ含有二价铁离子、镍离子、锌离子等杂质,加入硫化钠可除去铜离子、锌离子,然后加H2O2是将二价铁氧化成三价铁,调节溶液PH使三价铁以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体,
(1)FeS除去Cu2+的反应是沉淀的转化;
(2)①对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+;
②然后调pH沉淀Fe3+;
③依据铁离子遇到KSCN溶液呈红色设计实验检验是否除净;
(3)NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶;
(4)①在进行蒸发浓缩操作时,当大量晶体析出时,停止加热;
②为了提高产率,过滤后得到的母液要循环使用,应该回流到流程中d中;
③产品的纯度不够需要重新溶解、浓缩、结晶析出得到较纯净的晶体.
解答 解:废渣(除含镍外,还含有Cu、Zn、Fe等元素的化合物杂质),在硫酸溶解后过滤后除去不溶性物质,滤液Ⅰ含有二价铁离子、镍离子、锌离子等杂质,加入硫化钠可除去铜离子、锌离子,然后加H2O2是将二价铁氧化成三价铁,调节溶液PH使三价铁以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体,
(1)FeS除去Cu2+的反应是沉淀的转化,即FeS+Cu2+=CuS+Fe2+;
故答案为:FeS+Cu2+=CuS+Fe2+;
(2)①对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,加入H2O2的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2 H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2 H2O;
②调滤液ⅡpH的目的是除去Fe3+,Fe3++3H2O?Fe(OH)3+3H+,平衡正向进行程度铁离子,
故答案为:除去Fe3+;
③检验Fe3+是否除尽的操作和现象是用试管取少量滤液Ⅲ,滴加几滴KSCN溶液,若无颜色变化,则Fe3+已除净;
故答案为:用试管取少量滤液Ⅲ,滴加几滴KSCN溶液,若无颜色变化,则Fe3+已除净;
(3)NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶;
故答案为:增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4);
(4)①在进行蒸发浓缩操作时,当大量晶体析出时或溶液表面形成晶体薄膜,停止加热;
故答案为:溶液表面形成晶体薄膜或者有大量晶体析出;
②为了提高产率,过滤后得到的母液要循环使用,应该回流到流程中d中循环使用,
故答案为:d;
③产品的纯度不够需要重新溶解、浓缩、结晶析出得到较纯净的晶体,实验操作为重结晶选C,
故答案为:C.
点评 本题考查物质的分离提纯的实验方案的设计,侧重于学生的分析能力和实验能力的考查,题目难度较大,明确实验的目的和原理是解答该题的关键,注意把握基本实验操作.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
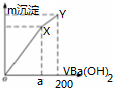
| A. | a=150 | |
| B. | Y点对应溶液为氨水 | |
| C. | OX、XY两段沉淀种类相同 | |
| D. | 继续滴加Ba(OH)2溶液,发生的离子反应为Al(OH)3+OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
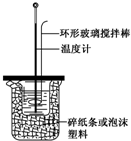
| A. | 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯 | |
| B. | 若用50 mL 0.55 mol•L-1的氢氧化钠溶液,分别与50 mL 0.50 mol•L-1的盐酸和50 mL 0.50 mol•L-1的硫酸充分反应,两反应测定的中和热不相等 | |
| C. | 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应 | |
| D. | 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能导电的有①②⑤⑥ | |
| B. | 属于电解质的有⑤⑦⑧ | |
| C. | 属于强电解质的有⑤⑥⑧ | |
| D. | 既不属于电解质又不属于非电解质的有①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 常温下单质能与水剧烈反应,所得溶液呈强碱性 |
| B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| C | 第三周期元素的原子中半径最小 |
| D | D的一种同位素可测定文物年代 |
| E | 次外层电子数比最外层电子数多2个 |
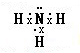 ,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com