
常温下,下列叙述错误的是
A.向0.1mol·L-1的醋酸溶液中加水或通入HCl气体都能使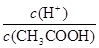 值增大
值增大
B.0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
C.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7
D.0.1mol·L-1某一元酸HA溶液中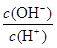 =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol/L
=1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol/L
B
【解析】
试题分析:A、醋酸是弱酸,存在电离平衡CH3COOH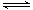 CH3COO-+H+。加入稀释促进醋酸的电离,氢离子的物质的量增加,醋酸的物质的量减少,所以
CH3COO-+H+。加入稀释促进醋酸的电离,氢离子的物质的量增加,醋酸的物质的量减少,所以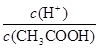 值增大。通入氯化氢气体,增大氢离子的浓度,抑制醋酸的电离,但氢离子增大的倍数大于醋酸增大的倍数,所以
值增大。通入氯化氢气体,增大氢离子的浓度,抑制醋酸的电离,但氢离子增大的倍数大于醋酸增大的倍数,所以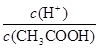 值增大,A正确;B、0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后生成醋酸和氯化钠,醋酸钠过量,且三种物质的物质的量相等。由于溶液显酸性,即c(H+)>c(OH-),这说明醋酸的电离程度大于CH3COO-的水解程度,所以c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),B不正确;C、醋酸是弱酸,存在电离平衡,则.pH=4的醋酸的浓度大于1×10-4mol/L,所以与pH=10的氢氧化钠溶液等体积混合醋酸过量,溶液的pH<7,C正确;D、0.1mol·L-1某一元酸HA溶液中
值增大,A正确;B、0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后生成醋酸和氯化钠,醋酸钠过量,且三种物质的物质的量相等。由于溶液显酸性,即c(H+)>c(OH-),这说明醋酸的电离程度大于CH3COO-的水解程度,所以c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),B不正确;C、醋酸是弱酸,存在电离平衡,则.pH=4的醋酸的浓度大于1×10-4mol/L,所以与pH=10的氢氧化钠溶液等体积混合醋酸过量,溶液的pH<7,C正确;D、0.1mol·L-1某一元酸HA溶液中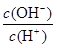 =1×10-8,则根据水的离子积常数可知,溶液中c(OH-)=
=1×10-8,则根据水的离子积常数可知,溶液中c(OH-)=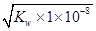 =1×10-11mol/L,因此溶液中由水电离出的c(H+)=1×10-11mol/L,D正确,答案选B。
=1×10-11mol/L,因此溶液中由水电离出的c(H+)=1×10-11mol/L,D正确,答案选B。
考点:考查外界条件对弱电解质电离平衡的影响、溶液中离子浓度大小比较、溶液酸碱性的判断以及溶液中氢离子浓度的计算等


 计算高手系列答案
计算高手系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com