
下列有关电解池的说法正确的是
A.在电解池中与外接电源负极相连的电极是阳极
B.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为2∶1
C.电解氯化铜溶液时,在阴极上有气体生成
D.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法中正确的是
A、1s22s12p1表示的是激发态原子的电子排布
B、元素的发射光谱一般是亮背景、暗线、线状不连续
C、同一原子中,1s,2s,3s电子的能量逐渐减小
D、各能层的能级都是从s能级开始至f能级结束
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高二上学期期末考试化学试卷(解析版) 题型:选择题
已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18;CuS:Ksp=6.3×10-36。下列说法正确的是
A.同温度下,CuS的溶解度大于FeS的溶解度
B.同温度下,向饱和FeS溶液中加入少量Na2S固体后,Ksp(FeS)变小
C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS
D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高二上学期期末考试化学试卷(解析版) 题型:选择题
某一反应物在一定条件下的平衡转化率为25.3%,当使用了催化剂时,其转化率为
A.大于25.3% B.小于25.3% C.等于25.3% D.不能确定
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省福州市高一上学期期中化学试卷(解析版) 题型:填空题
有一包白色粉末,可能是CuSO4、CaCO3、BaCl2、Na2SO4、KOH中的一种或几种,为证明其组成,进行如下实验:
(1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,则白色沉淀可能是 ,原混合物中一定不含有 ;
(2)向实验(1)滤出的白色沉淀中加入足量的盐酸,沉淀全部溶解,并产生无色气体。则原混合物中一定含有 。 该反应的离子方程式为 ;
(3)将实验(1)中得到的滤液分成两份,将实验(2)中产生的无色气体先通入其中的一份,无沉淀产生。气体导出后再通入另一份滤液中,立即产生白色沉淀,再过滤。出现上述现象的原因是实验(2)中产生的气体里含有 。
(4)向实验(3)中过滤后所得的滤液里加入AgNO3溶液和稀硝酸,又产生白色沉淀,根据此现象推断,原混合物中一定还含有 ,根据实验全过程推断,原混合物中还含有 。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省福州市高一上学期期中化学试卷(解析版) 题型:选择题
下列化学反应中,不属于氧化还原反应的是
A.KClO+CO2+H2O === KHCO3+HClO B.H2+CuO  Cu + H2O
Cu + H2O
C.Fe2O3 +3CO 2 Fe + 3CO2 D.2CO + O2
2 Fe + 3CO2 D.2CO + O2  2CO2
2CO2
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期末考试化学试卷(解析版) 题型:填空题
铁是目前用途最广,用量最大的金属。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是 。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式: 。
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
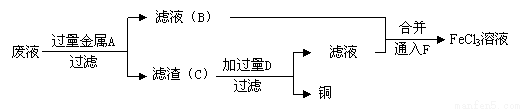
①滤渣C的化学式为 ;
②试剂F宜选用______(填选项序号),通入F的目的是_______________;
A.酸性KMnO4溶液 B.氯水 C.溴水
(4)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是 ;②溶液组成的测定:取30.0mL待测溶液,加入足量的AgNO3溶液,得25.83g白色沉淀。则溶液中c(Cl-)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com